

(图片来源:Nat. Catal.)
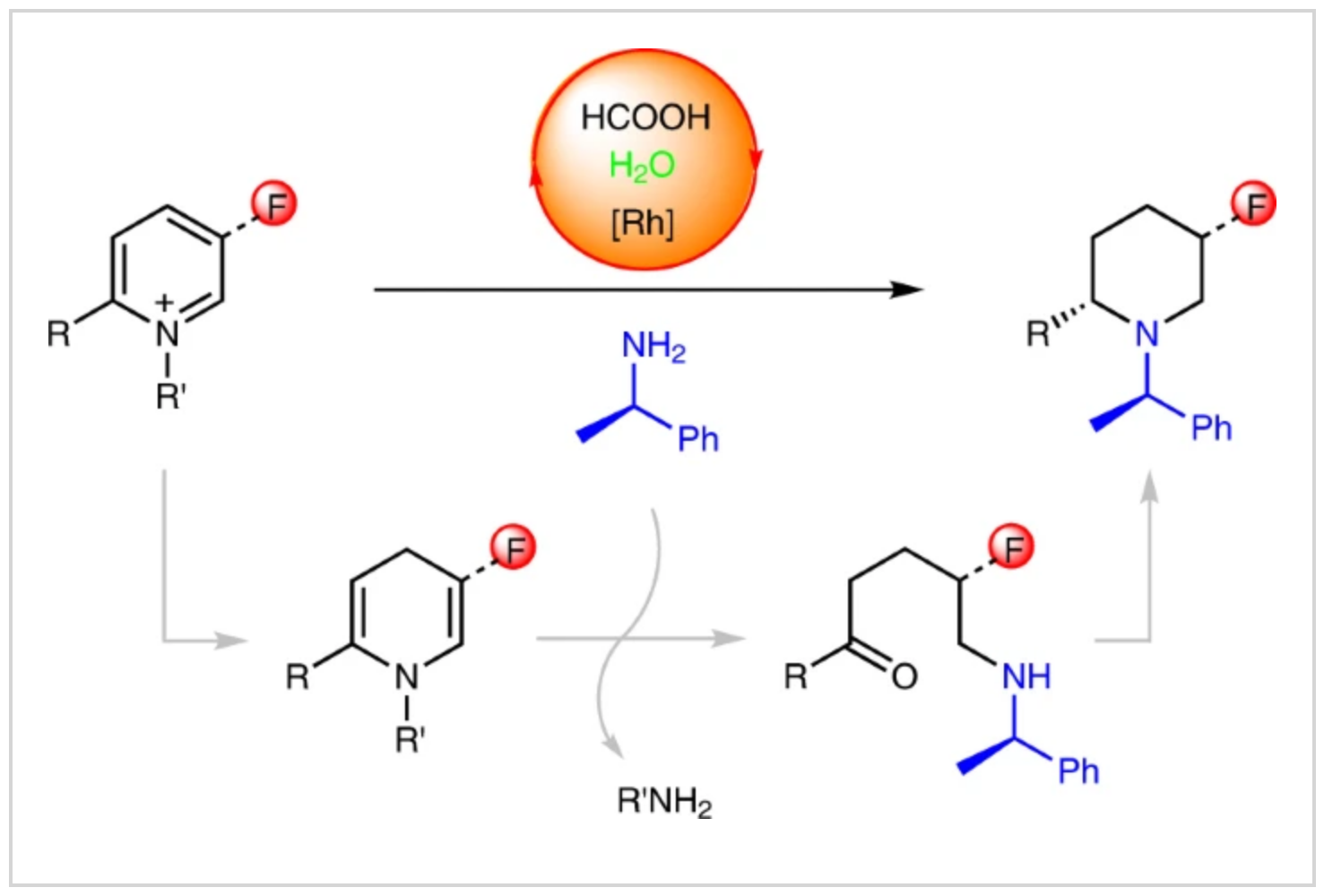
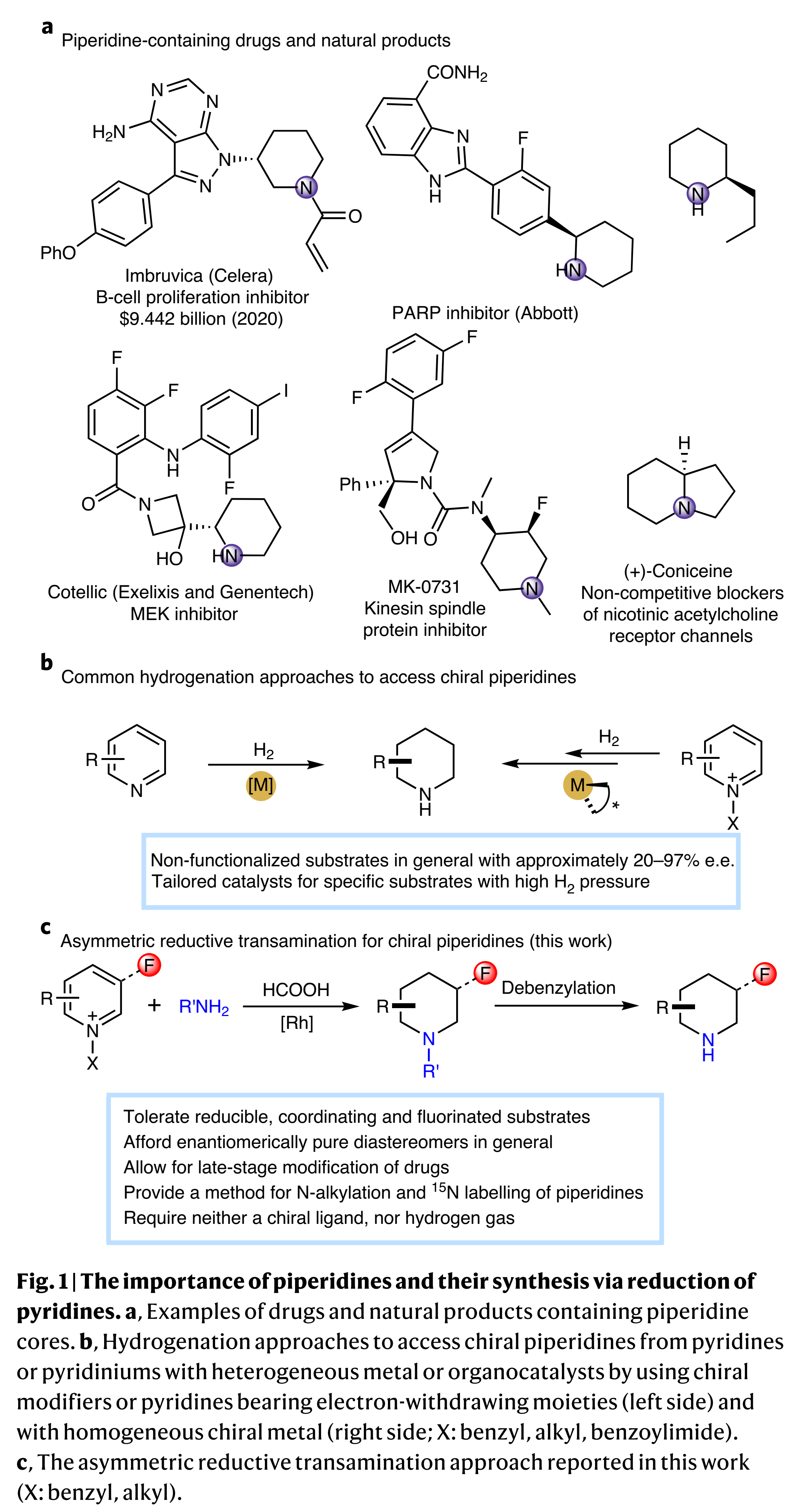
手性环状胺是一类重要的化学骨架,广泛存在于许多天然产物、生物活性分子以及药物中,在美国FDA批准的药物中,大约60%含有N-杂环,其中哌啶母核最为常见 (Fig. 1a)。在过去的二十年里,吡啶类的不对称氢化已经取得了很大进展,主要有两种方法:一种是中性吡啶的还原,而另一种使用活化的吡啶盐作为底物(Fig. 1b)。虽然,不对称氢化可以成功的合成手性哌啶化合物,但是这些方法具有一定的底物局限性和需要较高的氢气压力以及特殊的手性配体。此外,尽管氟和哌啶在药物中非常重要,但没有已知的催化剂能够实现普通氟吡啶或氟吡啶盐的不对称氢化,可能是由于加氢脱氟副反应的发生。因此,作者发展了一种不同于之前的氢化方法,称之为不对称还原转氨反应:手性胺转移到吡啶环中,取代母体吡啶中的氮原子,同时诱导产物哌啶的手性构建,其中转氨诱导作用是通过铑催化与甲酸的转移氢化实现的(Fig. 1c)。
(图片来源:Nat. Catal.)
肖建良教授课题组长期致力于不对称氢化反应研究。他们之前的工作中使用甲酸/三乙胺混合物作为氢源,[RhCp*Cl2]2和碘化钾原位产生催化剂,催化N-苄基吡啶鎓盐的转移氢化实现了哌啶衍生物的合成(Fig. 2a)。考虑到体系中胺的性质可能会影响到不对称转移氢化的对映选择性,接下来,作者试图引入手性胺,通过非共价相互作用营造手性环境并原位诱导该类反应的对映选择性的产生。令他们惊奇的是,当使用R(+)-α-甲基苄胺作为手性胺源替换三乙胺时,可以中等收率得到单一构型的手性胺源嵌合的化合物1,结果表明新的手性环境形成具有高的对映选择性。作者对1进一步脱苄基以及Boc保护,可以得到96% ee的产物1a,值得注意的是,产物的ee值随着所使用手性胺的光学纯度而变化,当PEA为99% ee值时,产物1a的ee值高达98% (Fig. 2b).
(图片来源:Nat. Catal.)
接下来,作者对反应条件进行优化,最终得到1 mol% [RhCp*Cl2]2作为催化剂,甲酸作为氢源,CH2Cl2/H2O (15:1)作为混合溶剂,40 ℃反应22h,为最佳反应条件。首先,作者对吡啶盐2-位不同种类取代基进行了考察,发现产物都具有中等到良好的收率以及优异的非对映选择性。与之前氢化方法相比,该方法可以很好地兼容可能被还原的官能团,比如,卤素(5,6,12和13),酮(7),氰基(9)、硝基(10)和酯基(11和27)。特别值得注意的是,该反应还可以兼容多官能团的化合物,例如化疗药物维莫德吉(14),以及杂环取代基,如吡啶、呋喃和噻吩(17、18、19和20)。同样值得注意的是,该反应同样可以兼容位阻相对较小的烷基取代基(21-23),以及烷基上各种官能团(26-29),并高效得到单一构型的产物(Fig. 3)。
(图片来源:Nat. Catal.)
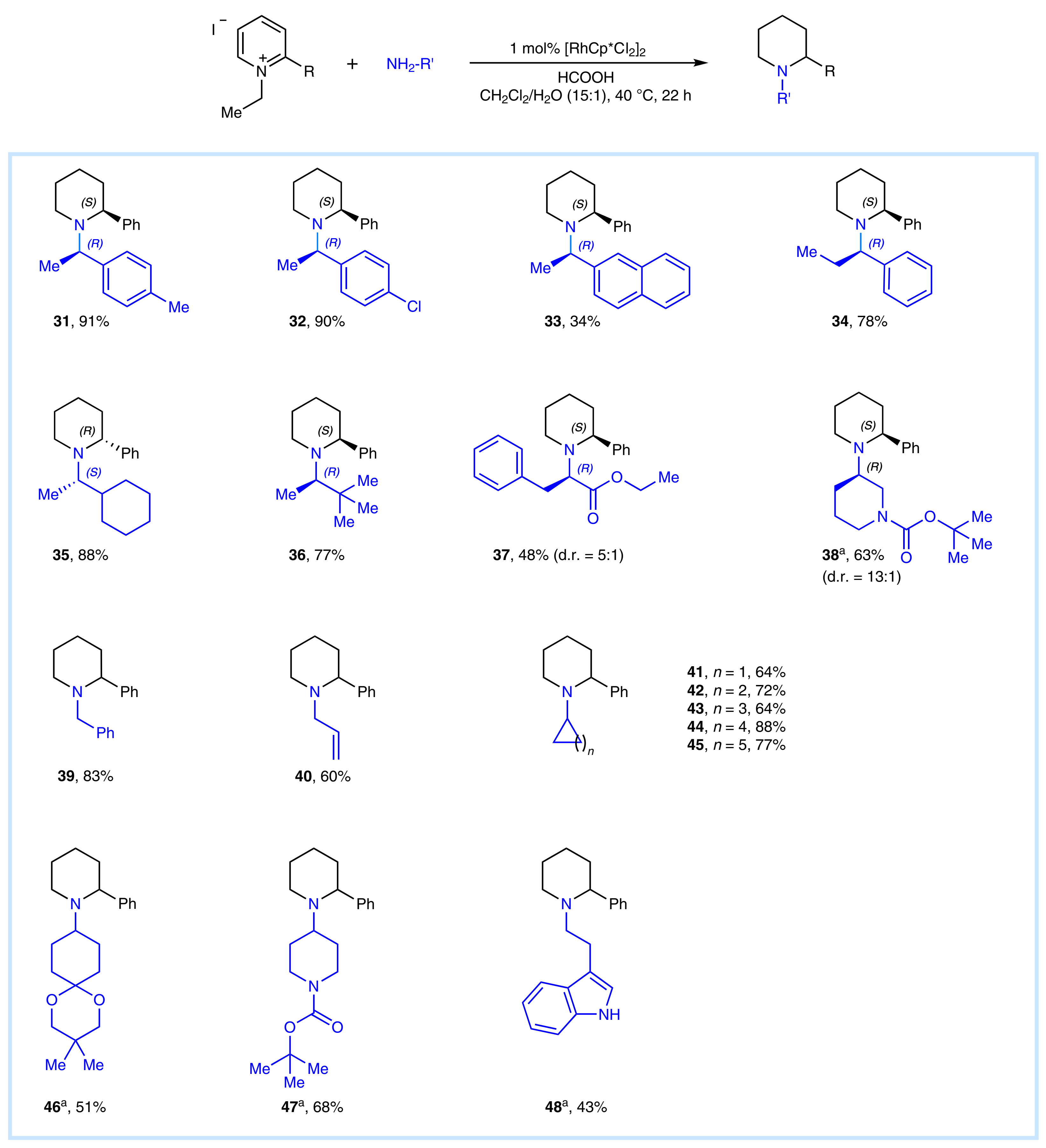
作者对不同种类的手性以及非手性胺源进行了考察,该方法可以单一步骤合成各种带有环状和非环状N-烷基哌啶类化合物(31-48)。值得注意的是,一些单胺生物碱包括,D-苯丙氨酸乙酯(37),(R)-1-Boc-3-氨基哌啶(38),烯丙胺(40)和色胺(48),都可以很好地嵌合到产物中(Fig. 4)。作者观察到产物37和38的非对映异构体,这可能是因为在对映区分能力方面进攻性手性胺的要比PEA弱。值得注意的是,将胺的量降低到1当量是也是可行的(38, 46-48)。
(图片来源:Nat. Catal.)
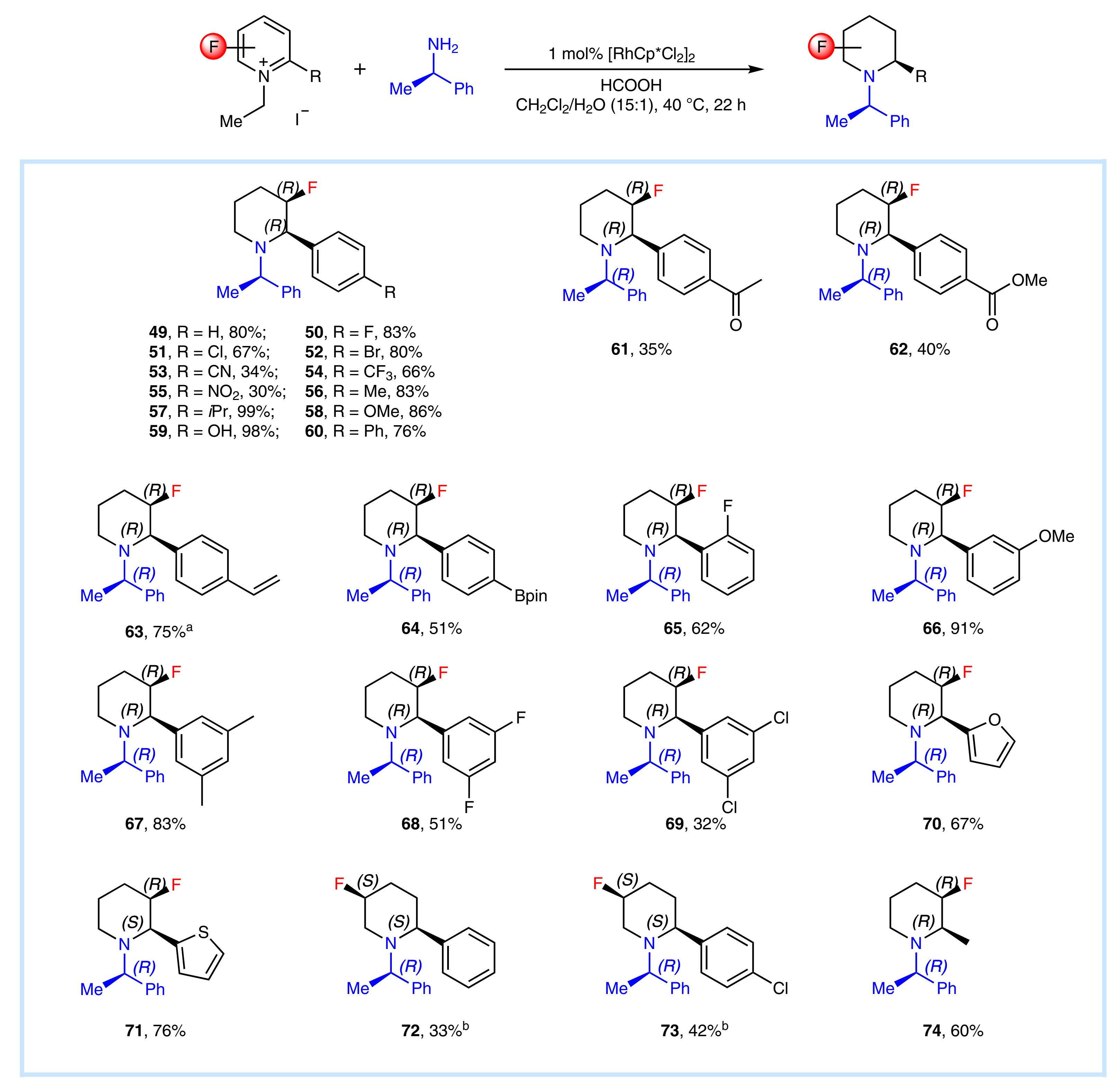
由于氟的原子半径小且电负性高,氟在药物发现中起到至关重要的作用。因此,作者把目光转移到含氟吡啶底物,在标准条件下可以以良好的产率合成手性氟化哌啶衍生物(Fig. 5)。然而,带有吸电子共轭基团的底物活性相对较低(53、55、61和62)。值得注意的是,2,3-,2,5-二取代的吡啶盐,可以得到优异的顺式产物。同样的,体系中一些可能被还原的官能团,包括卤化物(50-52、65、68、69和73)、氰基(53)、硝基(55)、酮(61)、酯(62)和烯烃(63)都能很好的兼容。
(图片来源:Nat. Catal.)
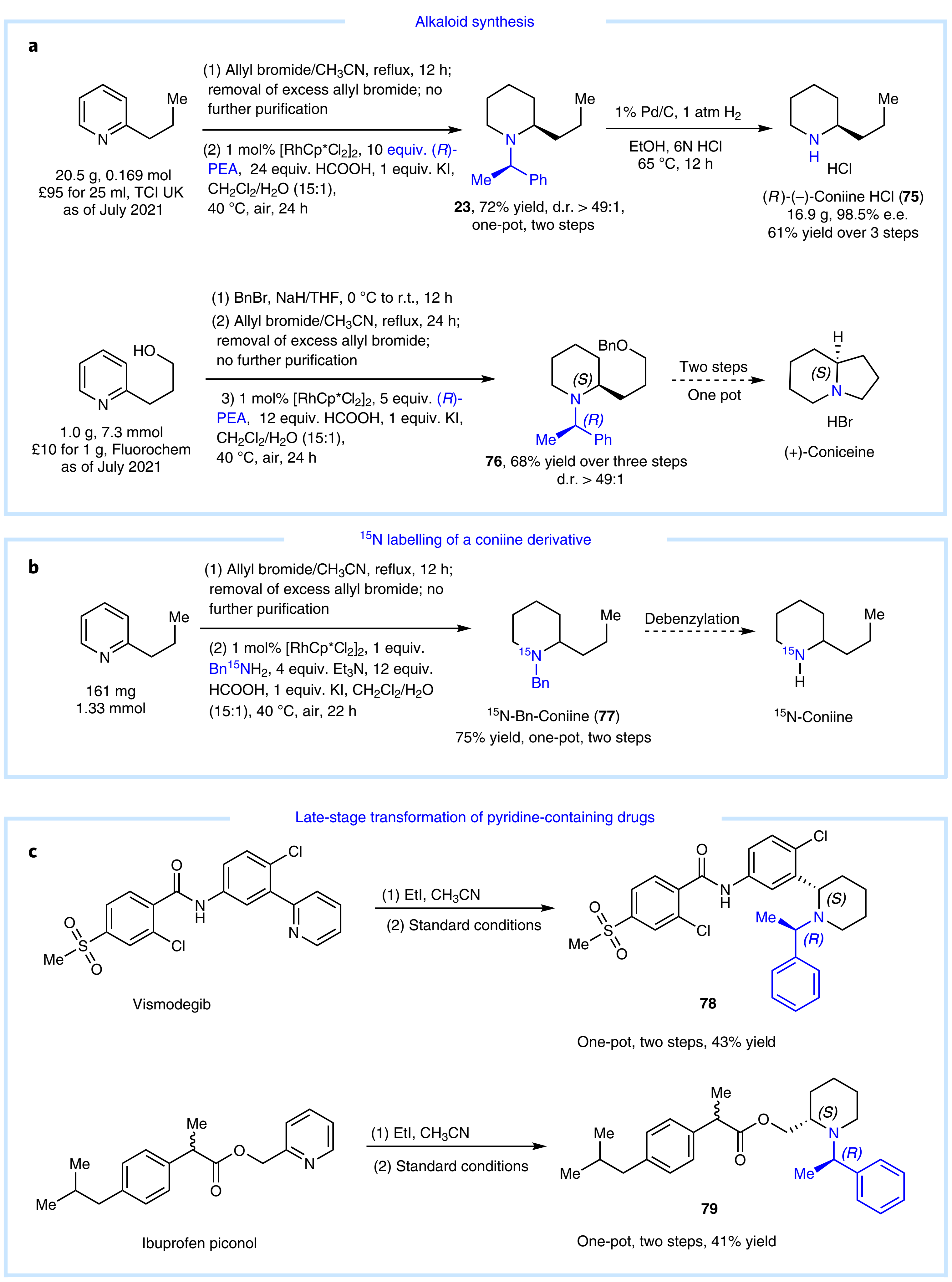
为了考察该反应的应用价值,作者进行了克级制备,从廉价的原料开始,经过三步反应可以实现十几克规模 (R)- (−)-毒芹碱盐酸盐75的合成, 同样该反应也很容易地合成具有生物活性的(+)-去氢毒芹碱 (Fig. 6a)。值得注意的是,作者使用15N标记的苄胺作为底物,可以以75%的产率合成15N标记的(-)-毒芹碱77(Fig. 6b)。除此之外,作者也对复杂药物分子(维莫德吉、匹美诺芬)进行了后期修饰,并以一锅两步中等收率得到目标产物78,79(Fig. 6c)。
(图片来源:Nat. Catal.)
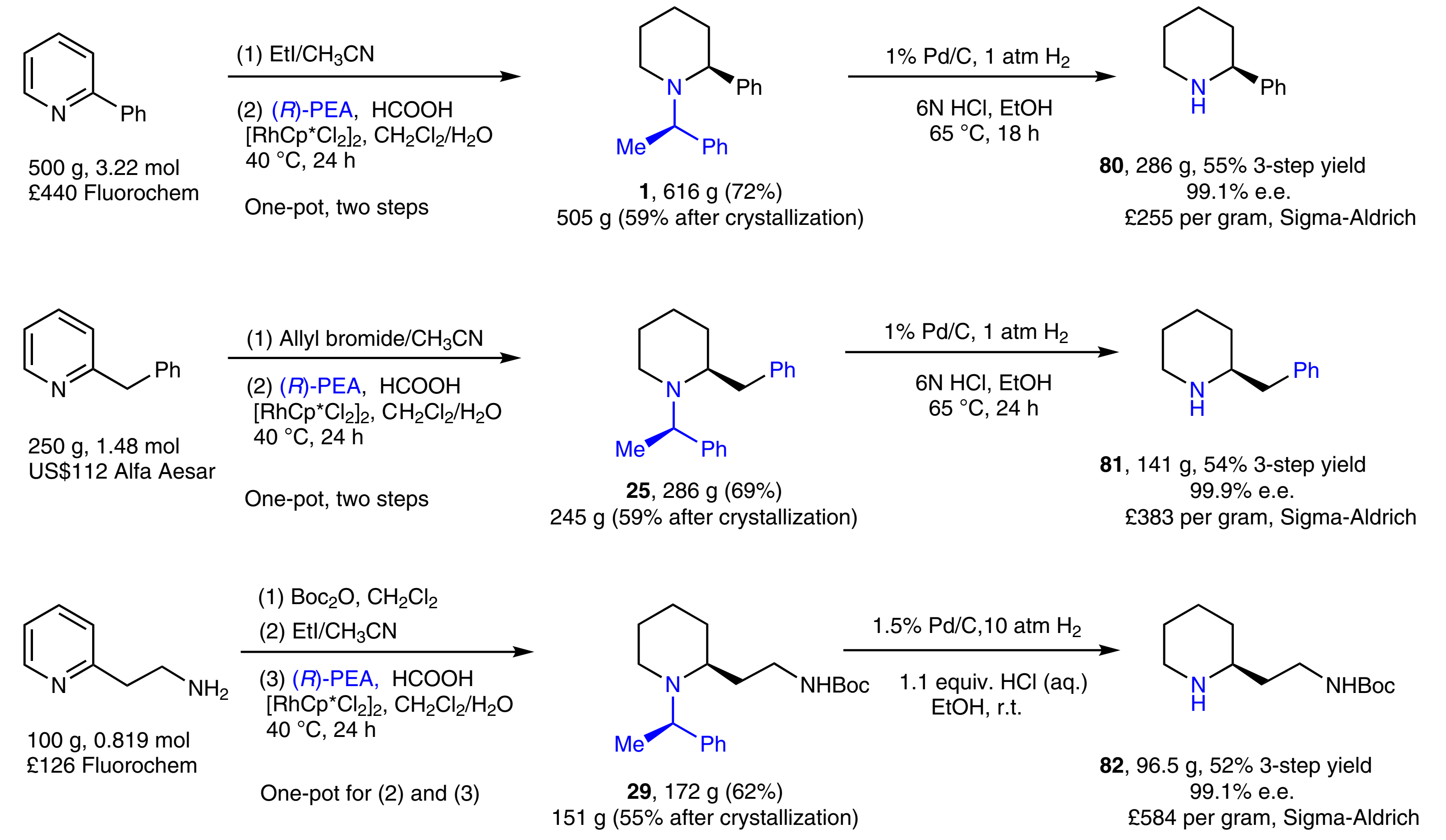
为了进一步验证该反应的反应规模,作者进行了几百克规模的制备(Fig. 7),并都可以以较高的收率以及优异的对映选择性得到目标产物。
(图片来源:Nat. Catal.)
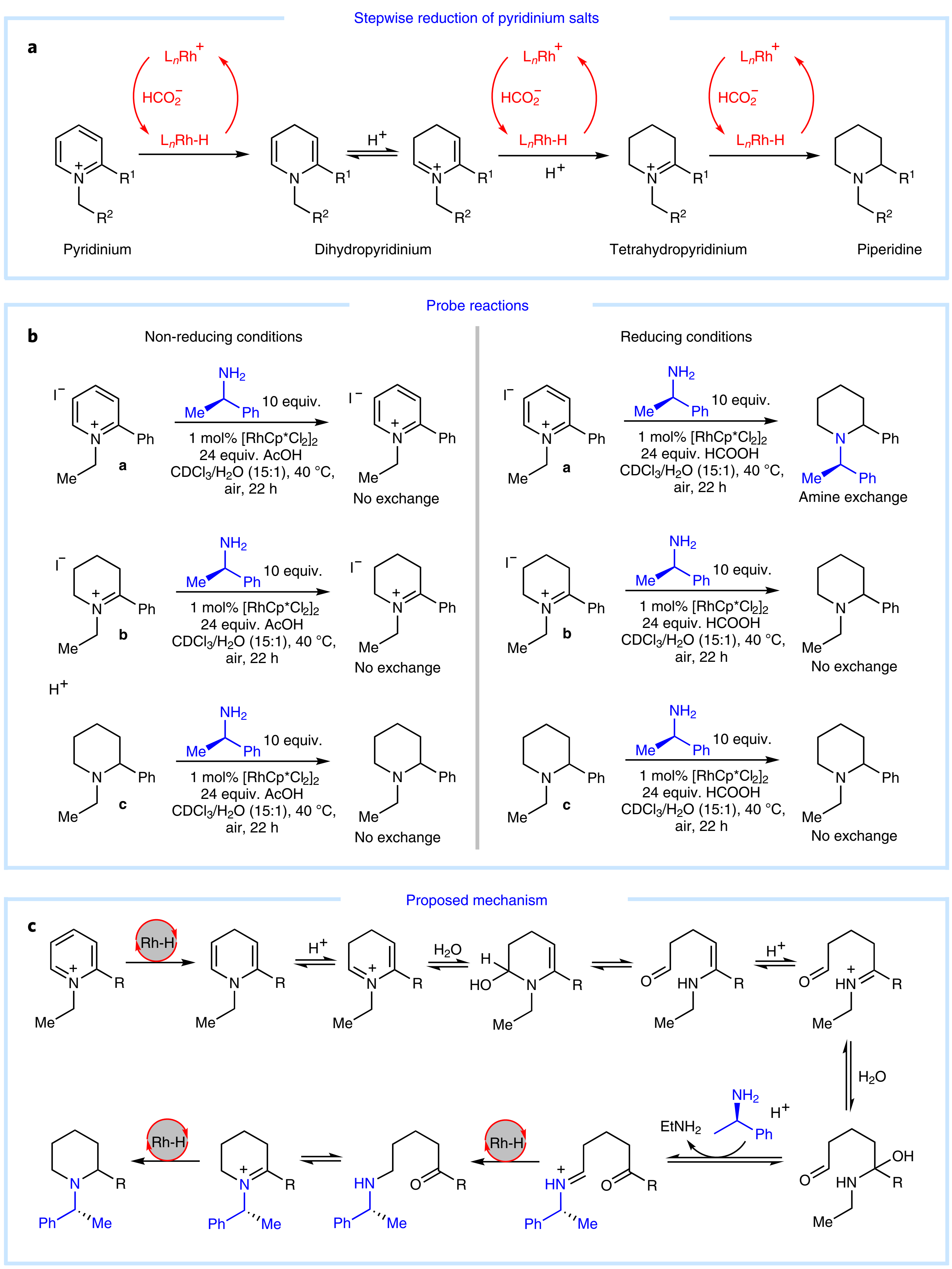
根据该课题组之前的研究以及前人的报道,作者提出该反应可能通过从铑氢物种的1,4-加成开始,连续三次氢化加成和质子化过程(Fig. 8a),并得到氘代实验验证。通过上述15N标记以及胺手性保持实验,作者断定反应中发生胺交换过程。为了验证胺交换发生的具体步骤,作者合成了两个可能的反应中间体b,c,首先在乙酸换成甲酸的非还原条件下,作者发现原料a和两种中间体都不能发生胺交换,于是排除了Zincke 类型的机理;其次,作者在还原的条件下,发现中间体b和c同样无法实现胺交换。由于原料吡啶盐a没有发生胺交换,作者可以断定胺交换必须通过由起始物形成的二氢吡啶中间体产生(Fig. 8b)。
基于上述的实验,作者提出了可能的反应机理(Fig. 8c)。体系中的水捕获二氢吡啶离子是反应的关键步骤,这导致二氢吡啶的开环并最终通过酸辅助水解释放乙胺分子,开环产物与PEA缩合,接着闭环和还原,生成最终目标产物。
(图片来源:Nat. Catal.)
总结 英国利物浦大学化学系肖建良教授课题组实现了铑催化的吡啶盐还原氨转移反应,该反应具有优异的立体选择性以及良好的底物兼容性。实验结果表明,体系中水和胺源是反应成功的关键。值得注意的是,该反应可以进行大规模的制备,为药物的发现以及大量生产提供了新的策略。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn