- 首页
- 资讯
JACS:精氨酸ADP-核糖基化:翻译后修饰泛素蛋白的化学合成
来源:化学加原创 2022-11-20
导读:近日,荷兰莱顿大学医学中心Dmitri V. Filippov和Gerbrand J. van der Heden van Noort团队在JACS上发表了题为“Arginine ADP-Ribosylation: Chemical Synthesis of Post-Translationally Modified Ubiquitin Proteins”的文章,开发和优化了用腺苷-二磷酸-核糖基(ADPr)基团制备在精氨酸残基上修饰的肽和蛋白质的方法。该方法包括将含有多肽的鸟氨酸与α-连接的异硫脲N-核糖苷反应,随后在核糖基部分的5′-羟基处安装磷酸单酯,然后转化为二磷酸腺苷。作者使用这种方法获得四种ADP-核糖基化泛素(UbADPr)的区域异构体,实现了在泛素(Ub)蛋白内不同精氨酸位置上的ADP-核糖基残基修饰,是作为完全合成精氨酸连接ADPr修饰蛋白的首例报道。
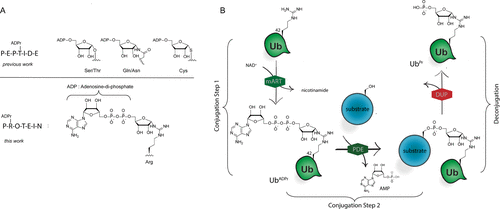
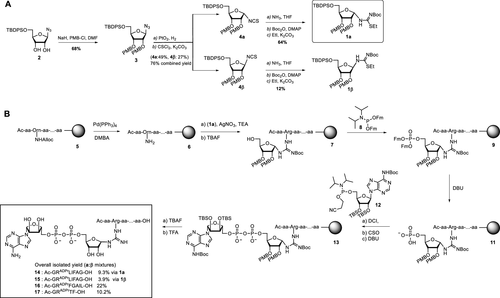
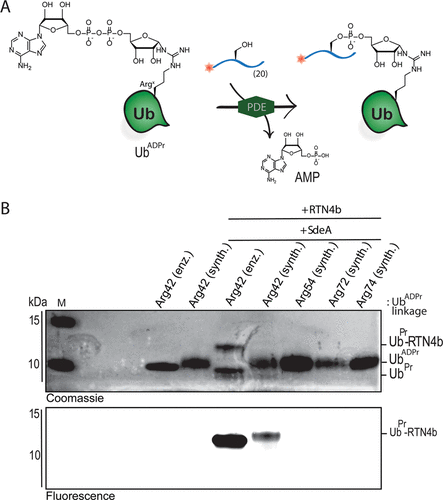
细胞内蛋白质的翻译后修饰(PTM)会影响蛋白质的功能、定位和广泛的细胞信号传导过程。PTM包括相对较小的基团,如磷酸盐或甲基,但也可能涉及更复杂的分子实体,如(多)糖苷和ADP-核糖(ADPr)部分,甚至整个蛋白质,如泛素(Ub)。在ADPr的情况下,单ADP-核糖基转移酶(mARTs)通过靶蛋白中的亲核氨基酸侧链催化烟酰胺从β-NAD中置换,从而通过α-构型的核糖键有效地将ADP-核糖连接到蛋白质。与大多数PTM一样,ADP-核糖基化是一个高度动态的过程,特异性写入器(mART)和橡皮擦(ADPr-水解酶(ARH))酶可以作用于特定的蛋白质或氨基酸。精氨酸残基的δ-胍基团的ADP-核糖基化通常由ART-C亚家族催化。军团菌使用SidE蛋白(SdeA、SdeB、SdeC和SidE)劫持真核宿主细胞的泛素途径,并以非常规的方式泛素化宿主细胞蛋白。这种多步骤级联从军团菌SidE mART结构域开始。随后,SidE中的磷酸二酯酶(PDE)结构域催化宿主细胞底物蛋白的丝氨酸与精氨酸连接的Ub之间形成磷酸二酯键ADPr同时排出一磷酸腺苷(Fig. 1B)。通过这种方式,细菌效应酶通过精氨酸-磷酸核糖键有效地将宿主Ub连接到宿主底物蛋白。Fig. 1: (A)本研究提出的进展和(B)嗜肺乳杆菌酶用于(去)泛素化宿主细胞底物蛋白的途径的示意。(图片来源:J. Am. Chem. Soc.)作者团队和其他人之前已经报道了ADP-核糖基化肽的合成,其中ADP-核糖连接到Ser、Thr或Cys、和Asn、Gln以及非天然氨基酸(Fig. 1A)。本文中,作者开发了一种普遍适用于在精氨酸上合成ADP核糖基化肽的方法,并将这种策略扩展到天然连接的ADP-核糖基化蛋白UbADPr的全化学合成。首先,作者进行了异硫脲核糖苷的合成。该化合物的合成始于5-O-((tert-butyl)-diphenylsilyl)-β-d-ribofuranosyl azide 2(Scheme 1A)。经过尝试,在硅藻土垫上过滤除去催化剂后,无需进一步处理或纯化所得滤液即连接异硫氰酸酯。最后,分别以64%和12%的产率获得核糖基异硫脲1α和1β。Scheme 1. 精氨酸连接的ADPr肽的合成方案。(图片来源:J. Am. Chem. Soc.)得到核糖基异硫脲1α之后,作者在树脂上进行了模型七肽14(Ac-GRADPrLIFAG-OH)的合成(B)。肽14来源于人Ub蛋白,含有已知在Arg42残基上被嗜肺乳杆菌效应酶ADP核糖基化的氨基酸。Nδ-Alloc保护的鸟氨酸被掺入肽序列中ADP-核糖基化位点上。经过Alloc保护和脱保护,使用AgNO3作为路易斯酸将构建单元1α对肽6进行胍基化修饰。LC-MS分析显示完全转化。接下来,对核糖基部分上的5′-OH进行脱硅烷、对伯醇进行磷化和PIII到PV氧化。对肽11的脱保护制备了用于PV到PIII与以TBS和Boc为保护基团的腺苷酰胺12偶联。随后,用DBU去除焦磷酸部分上的氰乙基保护基团,得到受保护的肽-ADPr 13。最后,在DCM中使用10%三氟乙酸(TFA)从树脂中裂解肽,经RP-HPLC纯化分离出肽14(总产率为9.3%),这是首个合成Arg连接的ADPr肽的例子。同时,尽管用于胍基化反应的异硫脲核糖是纯α-构型,作者通过1H NMR观察到异构体的混合物比例为6:4(α / β)。接下来,作者的合成方法从肽推断到蛋白质。化学合成Arg42UbADPr使用类似于获得肽14的方案进行,并通过小树脂样品的测试裂解进行监测。首先,经过脱保护暴露鸟氨酸部分的胺,与1α的树脂上胍基化反应顺利进行。随后的磷酸化、氧化和PV–PIII偶联产生完全保护的树脂结合Arg42UbADPr。作者通过孵育UbADPr证实了这种酸在TFA(90.5%)中1.5小时的稳定性(和庚聚体14)。使用这些条件,从树脂中完全裂解和整体脱保护,然后进行HPLC纯化,得到合成的Arg42UbADPr18的总收率为1.8%。通过在SPPS期间将Nδ-Alloc保护的鸟氨酸结合在蛋白质的另一位置,可以直接将ADPr基团引入到Ub中的其它精氨酸残基。作者成功地在Ub的Arg54、Arg72或Arg74上引入了UbADPr,获得共轭物19–21,总分离产率分别为1.8%、1.2%和1.7%。为了研究军团菌效应酶(DUPs)是否能够水解所合成的ADPr肽中的焦磷酸盐,作者将Ub衍生的Arg-ADPr七肽14与DupA孵育,并使用1H NMR进行了表征。结果证实了合成的Arg-ADPr肽被酶的催化活性识别和加工。此外,DupA似乎更喜欢α而不是β,水解α-构型的Arg-ADPr肽14(大约1.5 ×)比其β-异构体更快。这也与之前的报道相一致。受到DupA处理合成ADPr肽这一事实的鼓舞,作者接下来着手比较水解速率与酶促产生Arg42UbADPr的水解速率。将合成的ADPr肽在缓冲溶液中在DupA存在下进行孵育,并在指定时间使用高分辨率质谱分析(Fig. 2C)。在该水解测定中,酶Arg42UbADPr在30分钟内被DupA完全水解至Arg42UbPr。泛素衍生的庚聚体14和15的速率低于Arg42UbADPr,90分钟后分别显示48%和52%的水解。接下来,作者通过DupA孵育各自的UbADPr类似物,研究了所合成的4个UbADPr蛋白18−21的识别和水解情况,并与酶制备的Arg42UbADPr进行了比较。Arg42UbADPr在没有DupA的缓冲液中,长时间内不会导致水解。合成的Arg42UbADPr18和Arg42衍生的UbADPr庚聚体14几乎完全加工,酶Arg42UbADPr也是如此。尽管Arg74UbADPr低于Arg42UbADPr,但Arg74UbADPr的水解程度明显高于Arg54UbADPr和Arg72UbADPr。执行类似的测定并分析较早时间点(15-90分钟)的转换显示酶Arg42UbADPr15分钟后完全水解。Arg42UbADPr在这段时间内水解不太明显(30分钟后为52%)和(90分钟后为65%)(Fig. 3B),而其它三个UbADPr通过Arg72,Arg74和Arg54连接的DupA水解明显较少,佐证了DupA对Arg42的偏好。Arg42UbADPr可能是以与酶Arg42UbADPr相当的速度处理α-异构体。Fig.3. DupA介导的UbADPr水解成UbPr。(图片来源:J. Am. Chem. Soc.)作者的下一个目标是研究军团病发病的关键生物过程SdeA介导的底物ER蛋白与Ub ADPr的连接。作者合成了一种20聚体肽,来源于已知是SidE效应子底物的ER重塑RTN4b蛋白(23),在N-末端连接罗丹明荧光团。正如已经报道的那样,SdeA偶连Arg42UbADPr到肽23形成磷酸核糖连接Arg42Ub-RTN4b产物(Fig. 4A)并显示焦磷酸键的部分水解至Arg42UbPr。这证实了肽23是诱导PDE介导的连接Arg42UbADPr的合适底物,并且四种合成泛素18-21也可以参与这一过程。Fig.4. SdeA介导的UbADPr连接荧光RTN4b 20-聚体片段23。(图片来源:J. Am. Chem. Soc.)荷兰莱顿大学医学中心Dmitri V. Filippov和Gerbrand J. van der Heden van Noort团队开发了在精氨酸连接ADPr肽和蛋白质UbADPr的方法,是携带天然精氨酸键的ADP核糖基化蛋白质的首次全化学合成。ADPr肽和ADPr泛素区域异构体在水解和连接测定中能够被军团菌效应子(DupA和SdeA)识别。在精氨酸残基上进行定点引入ADPr的能力可以获得生化方法无法的得到的明确定义材料,并且在水解测定中,军团菌效应子DupA和SdeA有利于Arg42UbADPr联动。毫无疑问,该方法为肽和蛋白质提供天然ADPr氨基酸连接,用于分析参与安装和去除ADPr修饰的酶的位点特异性。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn