

(图片来源:J. Am. Chem. Soc.)
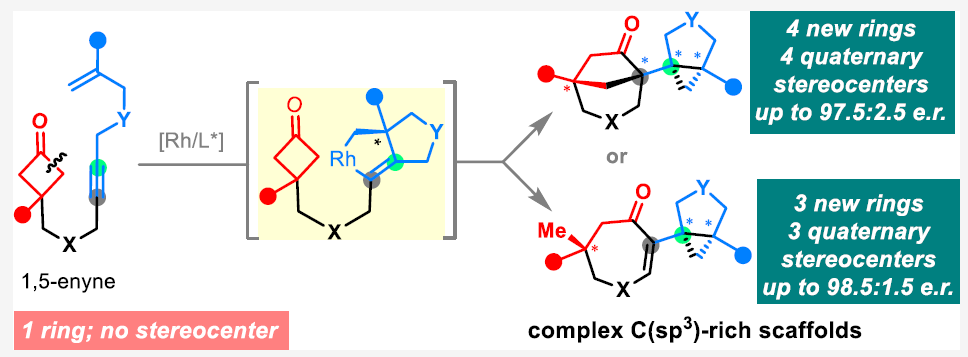
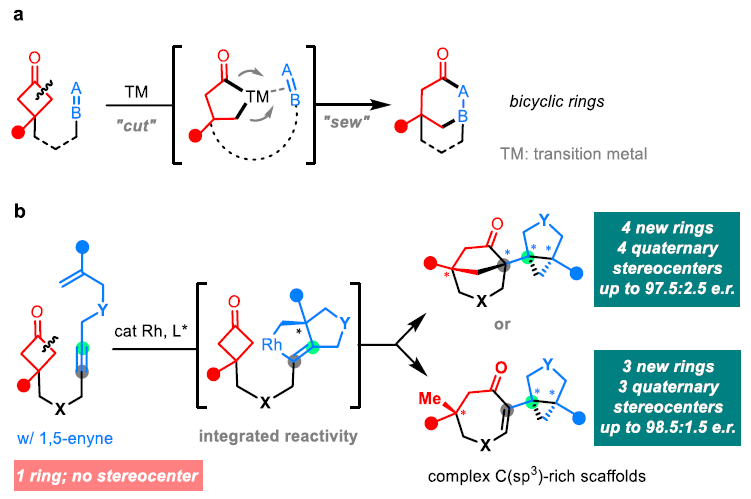
鉴于在药物研发过程中“escape from flatland”这一新兴需求,使得发展高效构建具有多个立体中心的复杂三维结构的合成方法具有重要价值。作为传统环化方法的补充,过渡金属催化的C-C活化反应通常可以使用相对简单的起始原料通过键重组来获得较为复杂的环结构。例如,过渡金属与环C-C键发生氧化加成后通过不饱和基团的插入(cut-and-sew过程),可以直接实现具有多个立体中心的多环骨架的构建(Scheme 1a)。而到目前为止,分子内的cut-and-sew反应仅仅局限于使用一个π-偶联配偶体参与反应,而多个π-偶联配偶体参与的反应却未有报道。最近,美国芝加哥大学董广彬课题组发展了Rh(I)-催化1,5-烯炔和环丁酮的分子内偶联环化反应,高非对映和对映选择性的快速构建了具有多个立体中心的C(sp3)富集多环骨架结构(Scheme 1b)。
(图片来源:J. Am. Chem. Soc.)
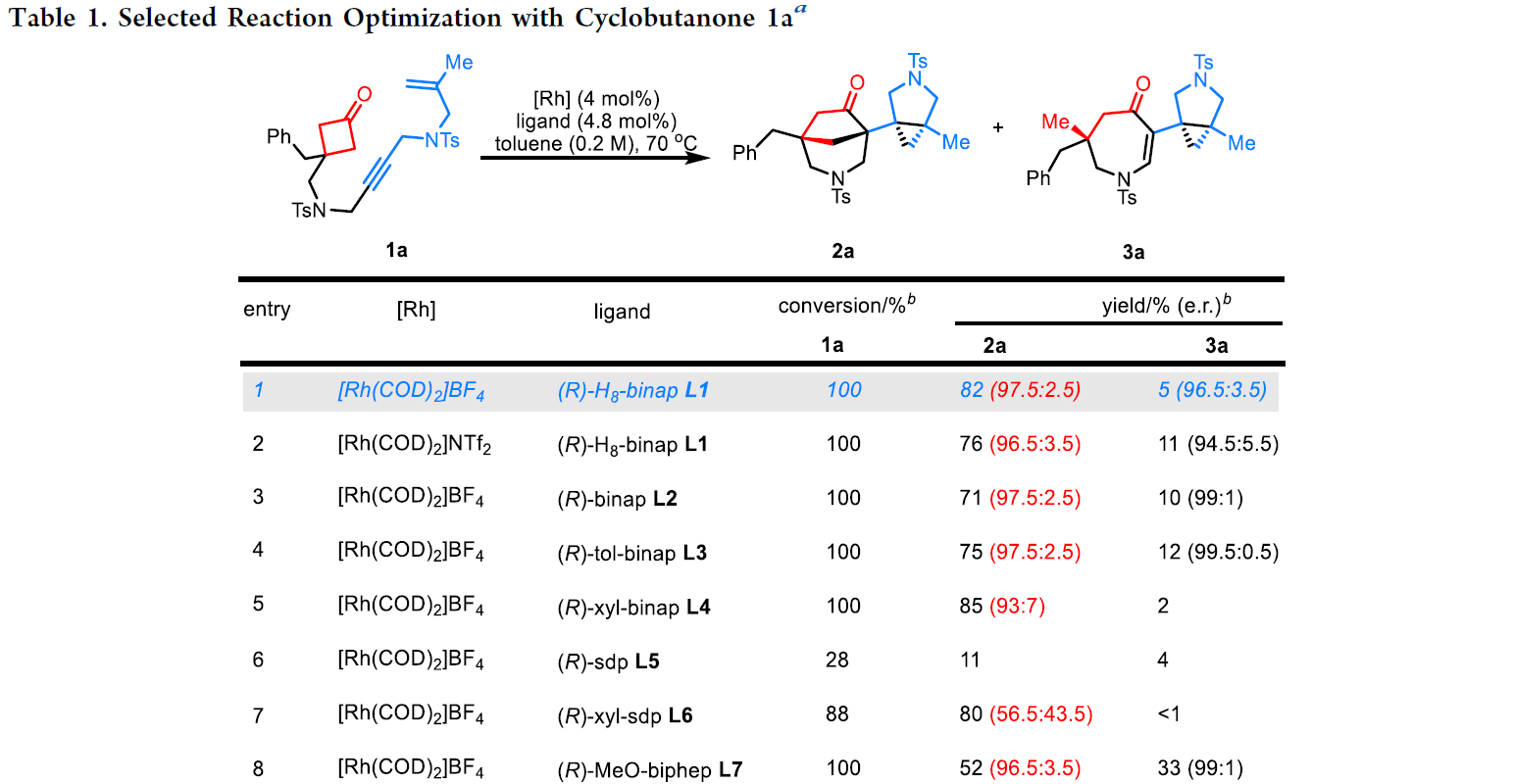
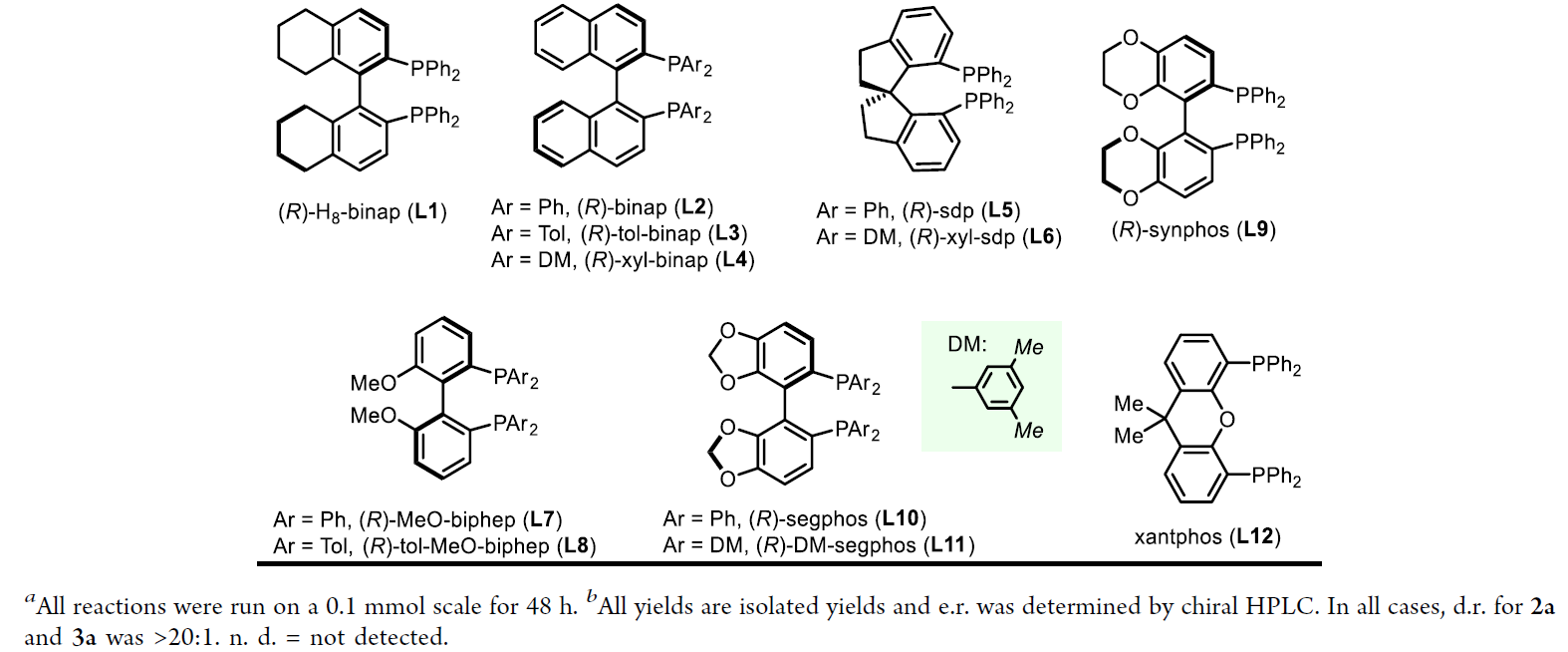
作者首先以1,5-烯炔串联的环丁酮1a作为模板底物进行反应尝试以及条件筛选(Table 1)。当使用4 mol% [Rh(COD)2]BF4和4.8 mol% (R)-H8-binap (L1),在甲苯(0.2 M)中,70oC下反应48小时可以以82%的产率得到双双环(bis-bicyclic)主要产物2a(e.r = 97.5:2.5),并伴随少量3a(5%,e.r = 96.5:3.5)生成(Table 1,entry 1)。接下来,作者通过进一步筛选发现当使用4 mol% [Rh(COD)2]NTf2和4.8 mol% (R)-segphos (L10)催化体系时,可以选择性的以82%的产率得到四氢氮杂蒎酮(tetrahydro-azapinone)3a(e.r = 96.5:3.5)为主要产物,并伴有12%的2a(e.r = 91.5:8.5)生成(Table 1,entry 12)。

(图片来源:J. Am. Chem. Soc.)
在得到了最优反应条件后,作者首先对双双环产物2合成的底物范围进行探索(Scheme 2)。实验结果表明,环丁酮C3位可以兼容Me、iPr、Et、CH2OBn、Ph、H、Bn等基团,以良好的产率和立体选择性实现产物2a-2k的合成。此外,含有1,1-二取代烯烃(2l, 2m)和单取代烯烃(2n, 2o)的底物均可顺利实现转化,以51-98%的产率实现产物2l-2o的合成。具有不同的桥连基团的底物,如NMs、NBs、N(p-Ns)、N(o-Ns)、O、C(COOMe)2均可兼容反应并顺利实现转化(2p-2v)。遗憾的是,强配位的保护基如乙酰基不能兼容。值得注意的是,当使用邻亚苯基连接的底物时仍可以实现反应(2w),但是产率相对较低(33%)。而当延长底物碳链后,在目前的催化体系下反应是不发生的。
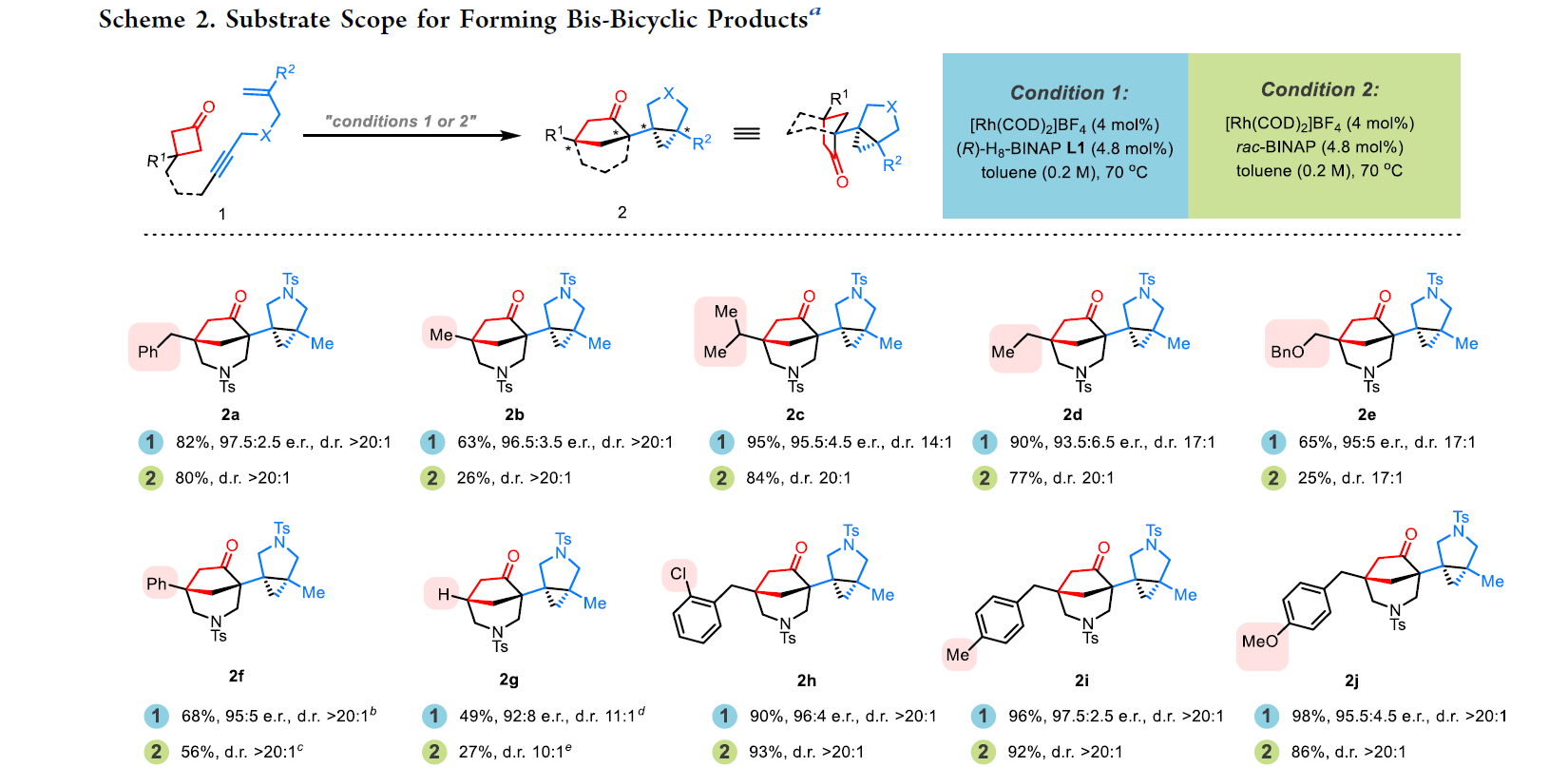

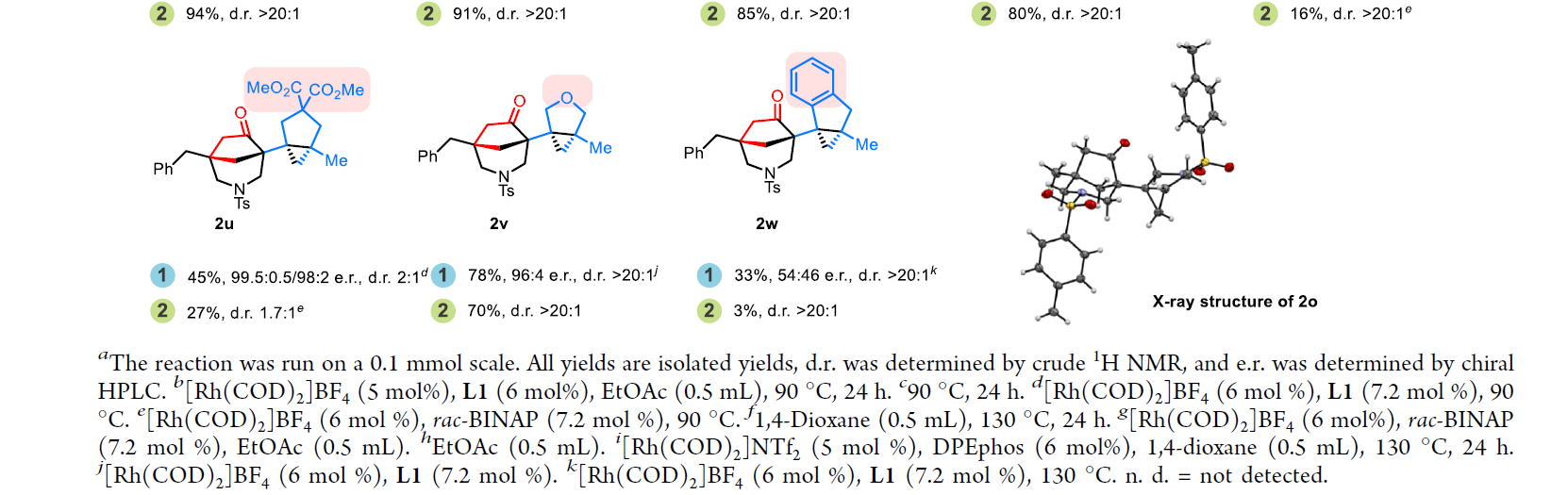
(图片来源:J. Am. Chem. Soc.)
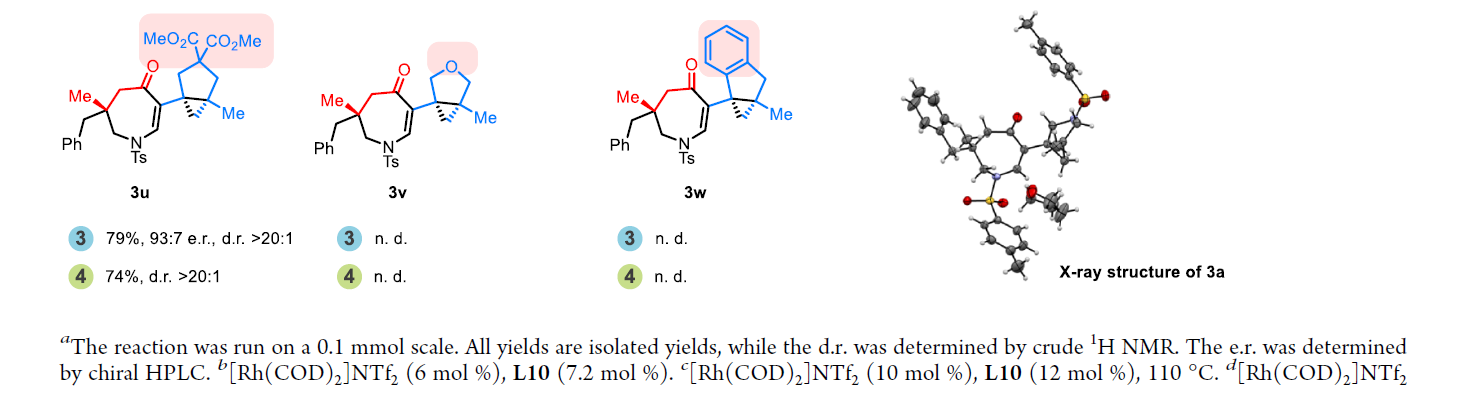
随后,作者对四氢氮杂蒎酮产物3合成的底物范围进行探索(Scheme 3)。通过对环丁酮C3位取代基(3a-3k)、烯烃部分的取代基(3l-3o)以及桥连基团的取代基(3p-3w)进行考察,作者发现产物3的生成对底物的整体立体环境更为敏感,且氧桥连(3v)和苯基连接的底物(3w)不能兼容反应体系。
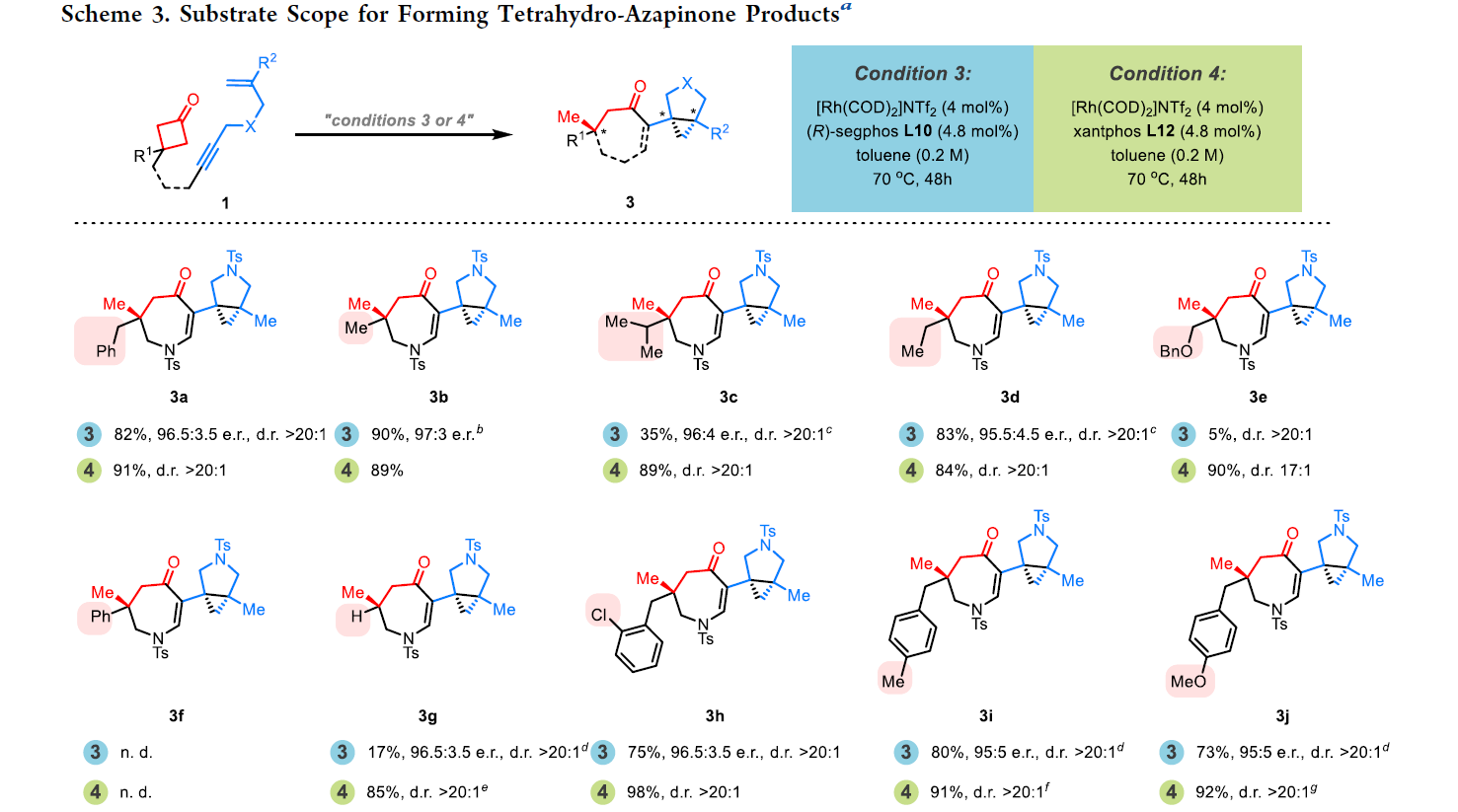
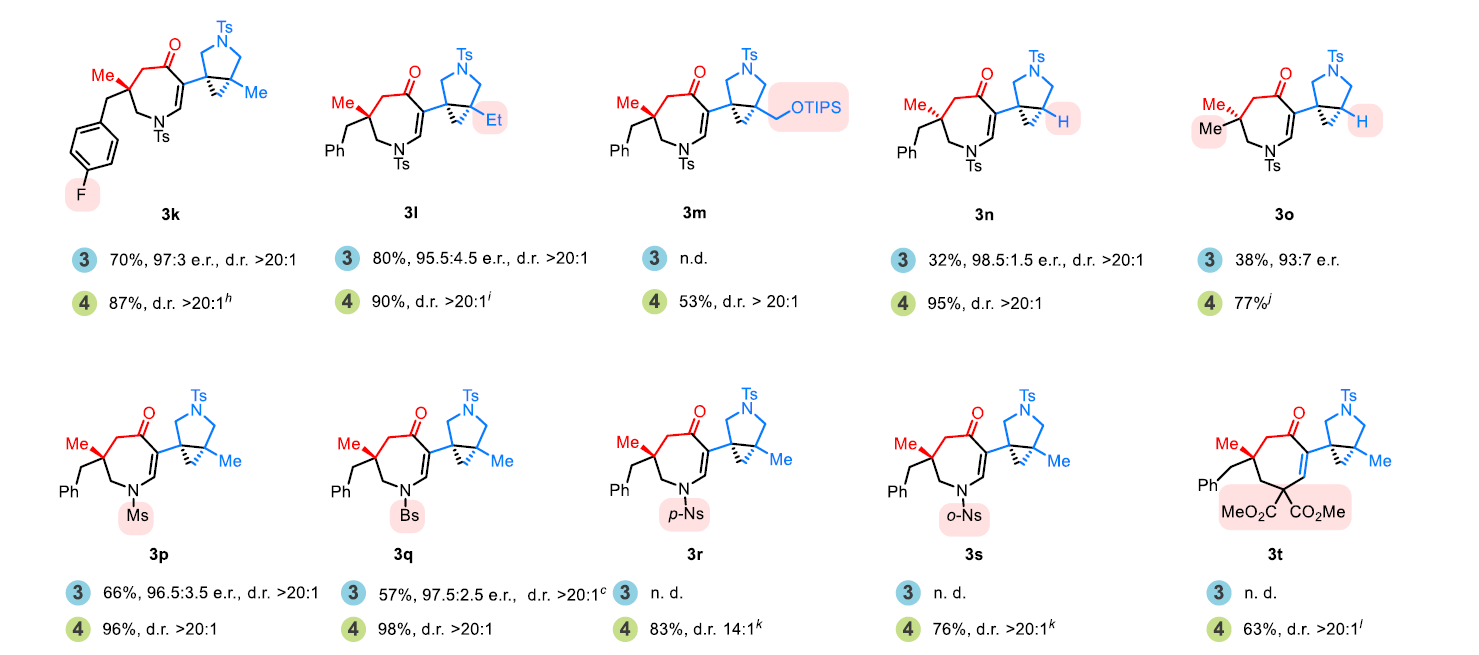
(图片来源:J. Am. Chem. Soc.)
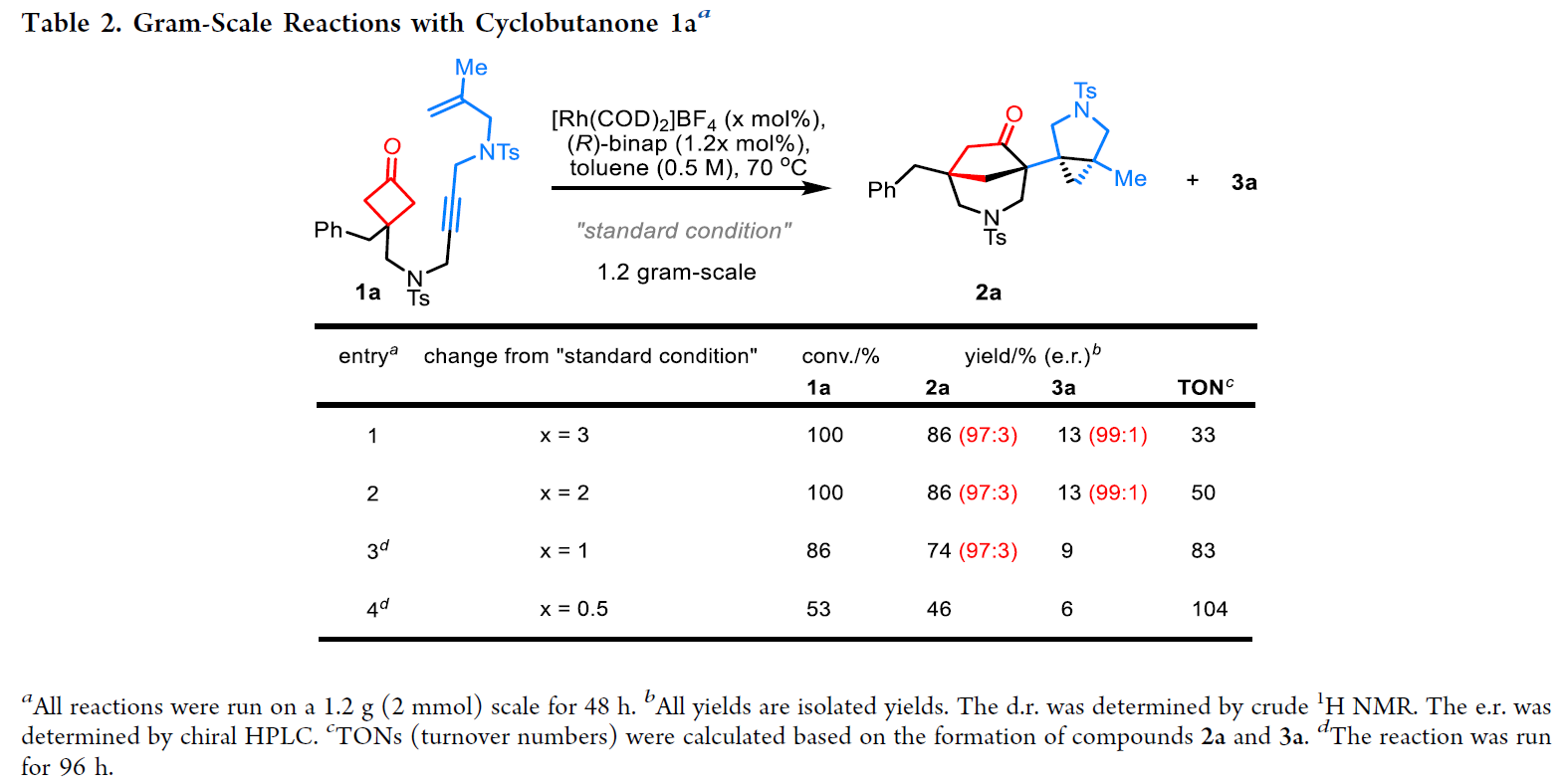
为了证明此转化的实用性,作者对双双环产物2a进行了克级规模合成(Table 2)。当将反应催化剂用量降低到3 mol%(entry 1)和2 mol%(entry 2)时,2a的产率仍可以达到86%。而当催化剂用量降低到1 mol%(entry 3)和0.5 mol%(entry 4)时,延长反应时间至96小时则可以分别以74%和46%的产率实现产物2a的合成。
(图片来源:J. Am. Chem. Soc.)
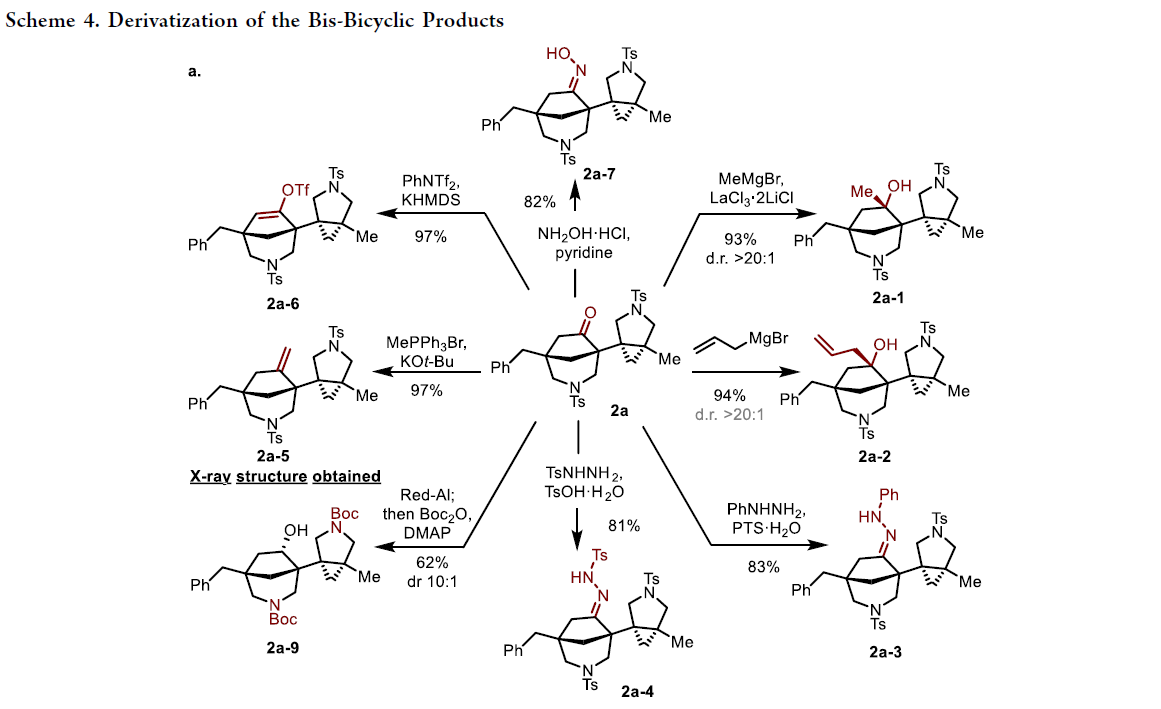
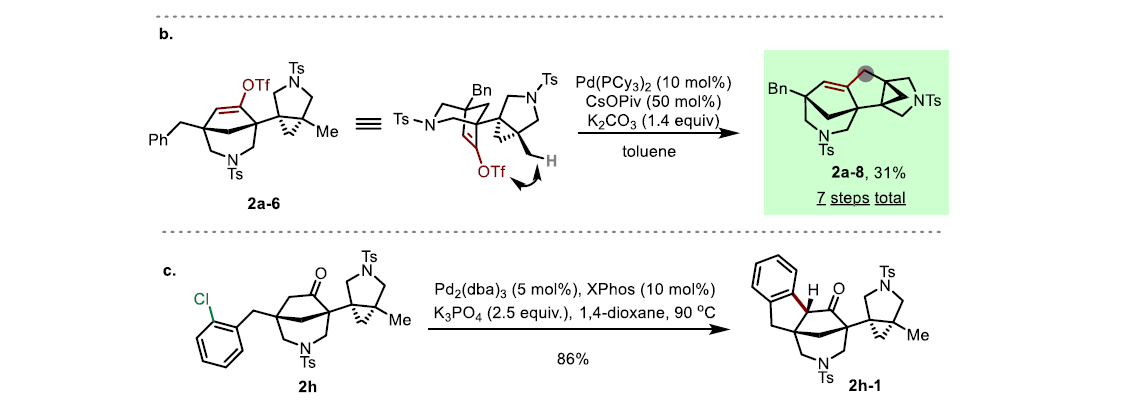
由于产物2a中含有高反应性的羰基官能团,因此作者对其进行了亲和加成、Wittig烯基化等多样合成转化得到衍生化产物2a-1-2a-7(Scheme 4a)。而产物2a-6又可以在钯催化下与远程甲基发生C(sp3)-H活化实现高度复杂的五环化合物2a-8的合成(Scheme 4b)。此外,2h可以通过钯催化的Buchwald-Hartwig-Miura α-芳基化反应条件以86%的产率实现多环产物2h-1的合成(Scheme 4c)。
(图片来源:J. Am. Chem. Soc.)
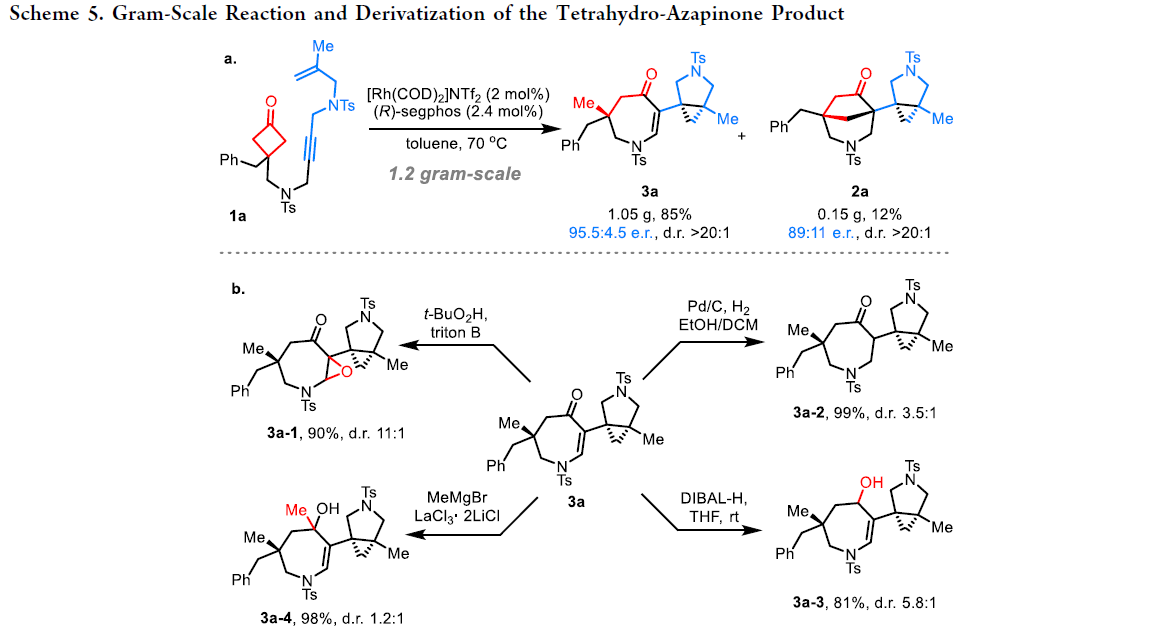
接下来,作者对四氢氮杂蒎酮产物3a的克级规模合成进行了探索(Scheme 5a)。当使用2 mol%铑催化剂时,和小规模合成相比产物3a的产率(85%)有所提升,而e.r.有所降低(e.r. = 95.5:4.5)。此外,产物3a的烯酮部分可以发生如亲核环氧化、氢化、1,2-加成、还原等合成转化(Scheme 5b)。与产物2a的结构相比,产物3a的结构更具柔性。因此除了环氧化之外,其它的衍生化反应中均仅观察到中等或相对较低的非对映选择性。
(图片来源:J. Am. Chem. Soc.)
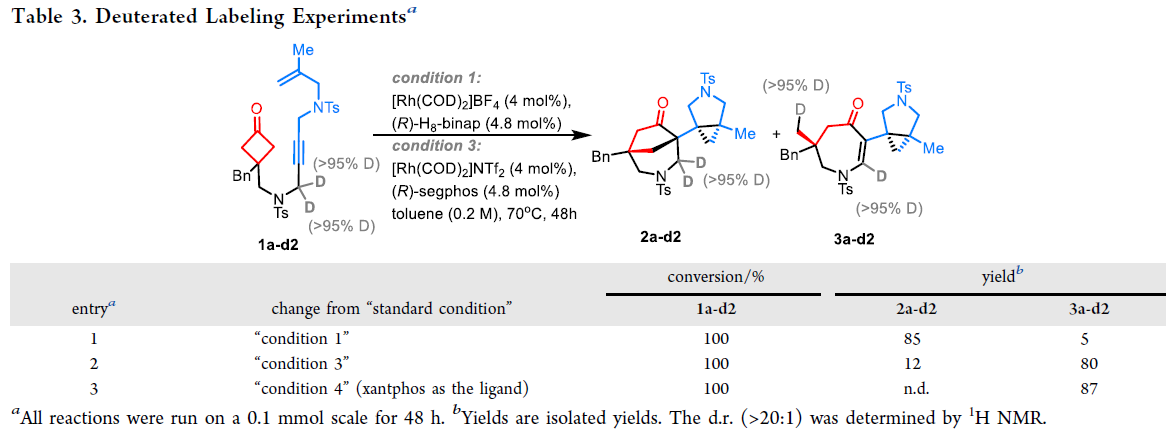
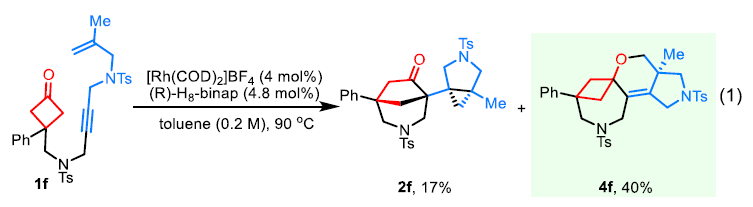
鉴于在产物3的形成过程中原料的一个炔丙位氢被消除从而形成烯烃部分,作者利用氘代实验对此过程进行探索(Table 3)。实验结果表明产物3a的形成可能包含β-H消除过程形成烯烃,随后通过C-H键的还原消除来实现Rh-H的转移。当使用1f作为起始原料时,在condition 1条件下可以以40%的产率观察到[2 + 2 + 2]环加成副产物4f,由此表明在此催化循环中包含环金属化过程(eq 1)。
(图片来源:J. Am. Chem. Soc.)
(图片来源:J. Am. Chem. Soc.)
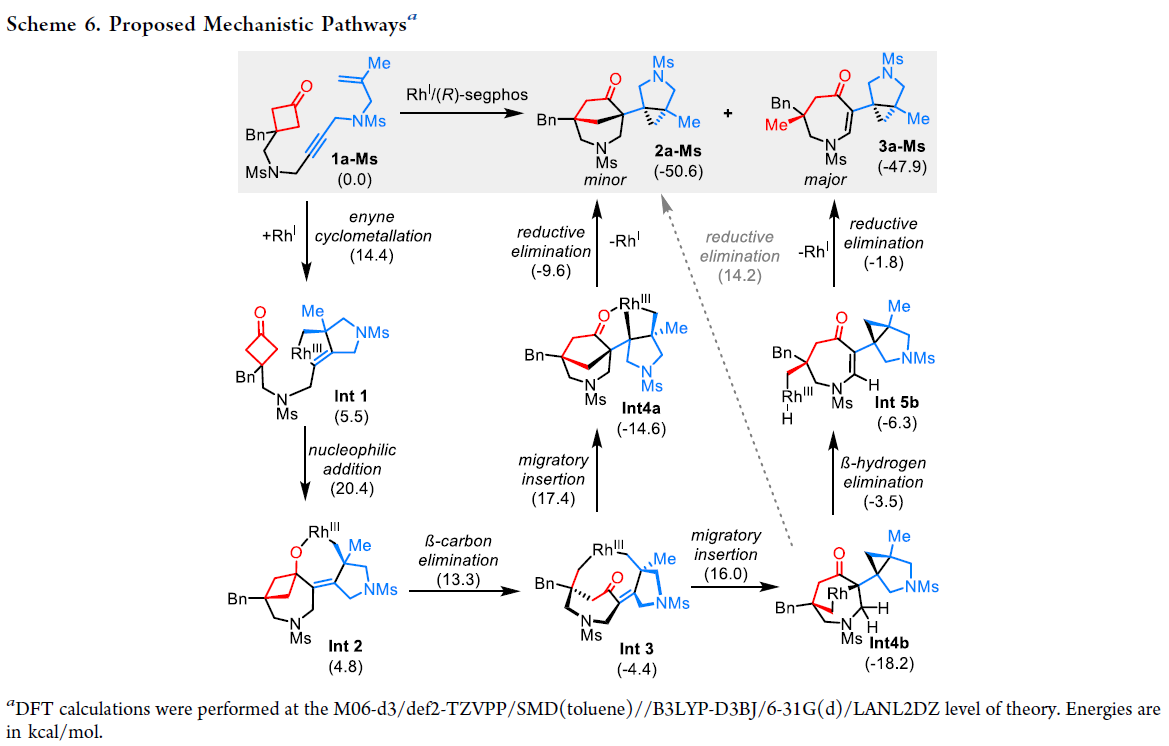
基于上述实验结果,作者提出了此转化可能的反应机理,并通过DFT计算得到证实(Scheme 6)。反应起始于1,5-烯炔的环金属化过程生成铑环络合物中间体Int 1,且此过程为立体选择性的决定步骤。随后铑环与环丁酮部分发生亲核加成得到七元铑环中间体Int 2。接下来,受到环张力的影响,使得Int 2发生β-C消除得到含有两个全碳季碳中心的大环桥环中间体Int 3。随后烯烃分别插入Int 3中的两根Rh-C键可以分别得到Int 4a和Int 4b。此过程可以利用催化体系进行调控,当使用(R)-segphos时,反应倾向于生成Int 4b。Int 4b随后经历β-H消除和C-H还原消除得到主要产物3a-MS。对于Int 4a,其直接经历C-C键还原消除得到次要产物2a-MS。原则上来讲,Int 4b也可以直接发生还原消除得到产物2a-MS。但是此过程需要跨越更高的反应能垒(32.4 vs 21.8 kcal/mol),因此发生可能性很小。
(图片来源:J. Am. Chem. Soc.)
总结 美国芝加哥大学董广彬课题组发展了Rh(I)-催化1,5-烯炔与环丁酮的分子内环化反应,高立体选择性的快速构建了具有多个立体中心的C(sp3)富集多环骨架结构。反应可以通过对催化体系的调控来实现不同产物的合成。机理研究表明反应涉及烯炔环金属化、1,2-羰基加成、β-C消除等过程,且产物的选择性主要受到双键与C-Rh键的迁移插入过程所影响。此转化具有良好的原子经济性和官能团兼容性,且可以进行克级规模合成。此外,合成出的产物可以进行多样合成转化,证明了此转化的实用性。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn