


(图片来源:J. Am. Chem. Soc.)
对映体富集的α-三级胺是药物和天然产物中的一个重要的结构单元(Figure 1A)。虽然它们可以使用手性助剂进行制备,但催化不对称方法尚不成熟。同时,三级硝基烷烃也可通过硝基的还原,合成相应的三级胺。因此,立体选择性制备三级硝基烷烃的方法非常有吸引力,但仍不发达,通常涉及过渡金属催化的烯丙基烷基化或有机催化的Michael加成和Aza-Henry反应。此外,二级硝基化合物(nitronates)与烷基卤化物的C-烷基化是构建全取代硝基烷烃的一个潜在的策略,但由于竞争性的O-烷基化易形成羰基副产物。目前,化学家们发现,具有特定缺电子亲电试剂的单电子转移(SET)机理,有利于进行C-烷基化反应。Watson课题组通过自由基机理实现了一系列通用的过渡金属催化(Cu或Ni)硝基化合物与简单烷基卤化物亲电试剂的C-烷基化反应。随后,Watson课题组报道了一种镍催化一级硝基化合物的不对称C-烷基化反应,合成了对映体富集的二级硝基烷烃。然而,对于通过硝基化合物与烷基卤化物进行的不对称C-烷基化构建三级硝基烷烃的方法,目前尚未有相关的报道。作者设想,酶是否能够催化硝基化合物进行不对称C-烷基化反应以生成三级硝基烷烃。与酶催化相关的高度选择性和进化性,使其成为一种具有吸引力的策略。尽管在各种生物催化的共轭加成或Henry反应中使用了硝基化合物作为亲核试剂,但没有一种方法能够构建手性三级硝基烷烃。值得注意的是,天然酶不能够催化硝基烷烃与烷基卤化物的C-烷基化反应。因此,作者设想,需要一种非天然的催化机理来应对这一挑战。2022年,Hyster课题组(Nature 2022, 610, 302.)报道了黄素依赖性“烯”还原酶(EREDs)可以催化烷基卤化物和硝基烷烃之间的不对称交叉亲电偶联(XEC)。该反应涉及烷基自由基的形成,可与硝基化合物反应形成硝基阴离子。酶介导的裂解(mesolytic cleavage)形成一个三级自由基,可以通过氢原子转移(HAT)立体选择性地淬灭。近日,美国康奈尔大学Todd K. Hyster课题组报道了一种有助于硝基自由基阴离子氧化以合成三级硝基烷烃的酶的鉴定和进化(Figure 1B)。烷基卤化物1的光诱导还原可生成烷基自由基4,可与原位生成的硝基化合物5反应,实现C-C键的立体选择性构建,生成硝基阴离子6,6可通过单电子氧化终止,获得所需的C-烷基化的硝基烷烃产物3。首先,作者以α-氯代酰胺1a与(2-硝基丙基)苯2a作为模型底物,进行了相关反应条件的筛选(Figure 1C)。当GkOYE作为催化剂,Tricine作为缓冲液(100 mM,pH 9.0),DMSO作为助溶剂,可在青色LED照射下室温反应24 h,可以56%的收率得到硝基烷烃产物3a,er为78:22。

(图片来源:J. Am. Chem. Soc.)
为了进一步提高反应的效率,作者进行了蛋白质工程(Figure 2)。研究表明,当使用三重突变体(D73C/A104H/Y264W,即GkOYE-G7)时,可获得96%收率与96:4 er的产物3a。

(图片来源:J. Am. Chem. Soc.)
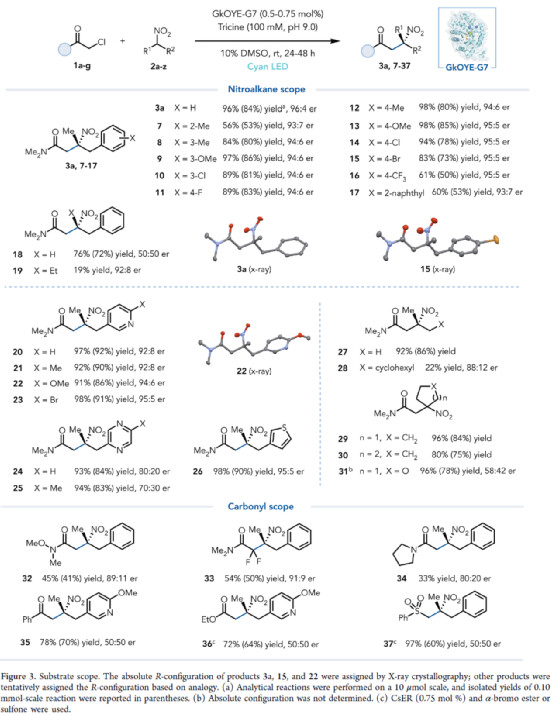
在获得上述最佳反应条件后,作者对底物范围进行了扩展(Figure 3)。研究表明,一系列不同取代的硝基烷烃,均可顺利进行反应,获得相应的产物3a与7-31,收率为19-98%,er为50:50-96:4。同时,三级酰胺、α-卤代酮、α-卤代酯或砜,也是合适的底物,获得应的产物32-37,收率为33-97%,er为50:50-91:9。
(图片来源:J. Am. Chem. Soc.)
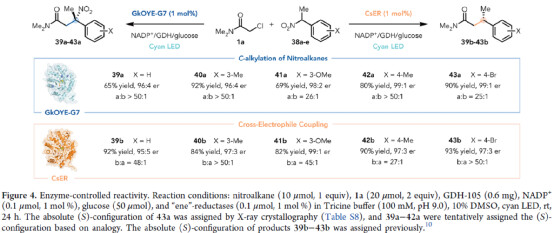
紧接着,作者对酶控反应性进行了研究(Figure 4)。研究表明,当使用GkOYE-G7催化体系时,反应可进行相应的C-烷基化反应,获得相应的产物39a-43a,收率为65-92%,er为96:4-99:1,a:b为25:1->50:1。当使用CsER催化体系时,反应还可进行相应的不对称交叉亲电偶联,获得相应的产物39b-43b,收率为82-93%,er为95:5-99:1,b:a为27:1->50:1。
(图片来源:J. Am. Chem. Soc.)
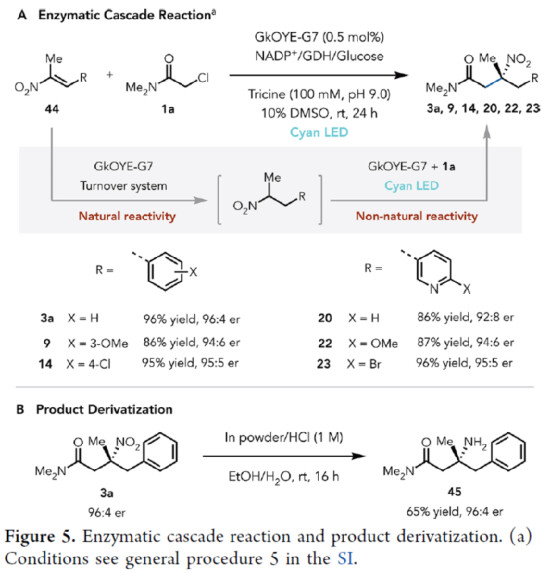
此外,作者以GkOYE-G7作为生物催化剂,通过将氢化物转移机理(天然催化活性)与光氧化还原自由基机理(非天然催化活性)相结合,可实现一系列硝基烯烃的烷基化反应,获得相应的产物3a、9、14、20、22和23,收率为86-96%,er为92:8-96:4(Figure 5A)。其次,3a可通过进一步的还原,可以65%的收率获得胺化产物45,er为96:4(Figure 5B)。
(图片来源:J. Am. Chem. Soc.)
最后,作者对反应机理进行了研究(Figure 6)。首先,GkOYE-G7在tricine缓冲液中于青色光照射下,通过UV-vis光谱监测发现,反应形成了FMNhq(flavin hydroquinone)和FMNsq(flavin semiquinone)的混合物(Figure 6A)。1a与2a在无光的条件下,未能发生反应,表明了基态FMNsq和基态FMNhq均不负责自由基的引发。同时,基态FMNhq、基态或激发态FMNhq均不能作为还原剂。通过进一步的研究表明,电荷转移(CT)配合物物负责α-氯代酰胺1a的还原(Figure 6B)。

(图片来源:J. Am. Chem. Soc.)
总结
美国康奈尔大学Todd K. Hyster课题组报道了一种光酶催化硝基烷烃的不对称C-烷基化反应 ,合成了一系列手性三级硝基烷烃。其中,该反应通过工程化的ERED(GkOYE-G7)实现,其特征是通过对映汇聚性Csp3-Csp3键的形成实现了四取代中心的构建。虽然进化的GkOYE-G7对催化硝基烷烃的C-烷基化表现出高度的专一性,但其仍保留了天然的还原反应性,通过一种独特的单酶双机理串联反应,从而实现了从易得的硝基烯烃合成手性三级硝基烷烃,该策略还解决了过渡金属催化硝基烷烃不对称C-烷基化中的长期挑战,扩大了生物催化的边界。
文献详情:
Haigen Fu, Tianzhang Qiao, Jose M. Carceller, Samantha N. MacMillan, Todd K. Hyster*. Asymmetric C‑Alkylation of Nitroalkanes via Enzymatic Photoredox Catalysis. J. Am. Chem. Soc. 2023, https://doi.org/10.1021/jacs.2c12197
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn