

化学反应的选择性有三种控制模式,即动力学控制、热力学控制和动态学控制。传统的化学反应的选择性通常是由热力学或者动力学控制的,直到最近二十年左右,人们才发现了动态学控制这一模式。动态学控制的反应选择性不能通过传统的过渡态理论来对产物分布进行预测,而需要使用分子动力学模拟。最常见的一类动态学控制的反应是具有分叉势能面的反应,该类反应在经历一个过渡态后反应路径会分叉生成两种或多种产物,而不是传统过渡态理论的一种产物。该种类型的过渡态被称为“两可”型过渡态(由北京大学余志祥教授和复旦大学蔡泉教授根据加州大学洛杉矶分校(UCLA)的K. N. Houk教授的ambimodal翻译而来)。例如,2015年余志祥课题组报道了金催化扩环和螺环化反应存在分叉势能面(J. Am. Chem. Soc. 2015, 137, 13290)。目前人们发现了越来越多动态学控制的反应,但是还没有一种反应同时包含动力学、热力学和动态学三种控制模式。
最近,北京大学化学学院余志祥课题组发现烯-烯酮亚胺正离子的分子内[2+2]环加成反应存在以上三种选择性控制模式。烯-烯酮和烯-烯酮亚胺正离子的分子内[2+2]环加成反应被广泛应用于含有环丁酮骨架的构建,该类反应可能得到具有并环结构的正常[2+2]环加成产物和具有桥环结构的交叉[2+2]环加成产物(图1)。但是关于这两种产物的选择性之前没有相关研究。早前该课题组发现烯-烯酮分子内[2+2]环加成反应的选择性几乎都是动力学控制的(Eur. J. Org. Chem. 2020, 37, 5985),而此次该课题组发现烯-烯酮亚胺正离子的分子内[2+2]环加成反应机理更为复杂,并非都由动力学控制,桥连基团、烯烃上的取代基以及烯烃的构型都会对反应结果产生显著影响。
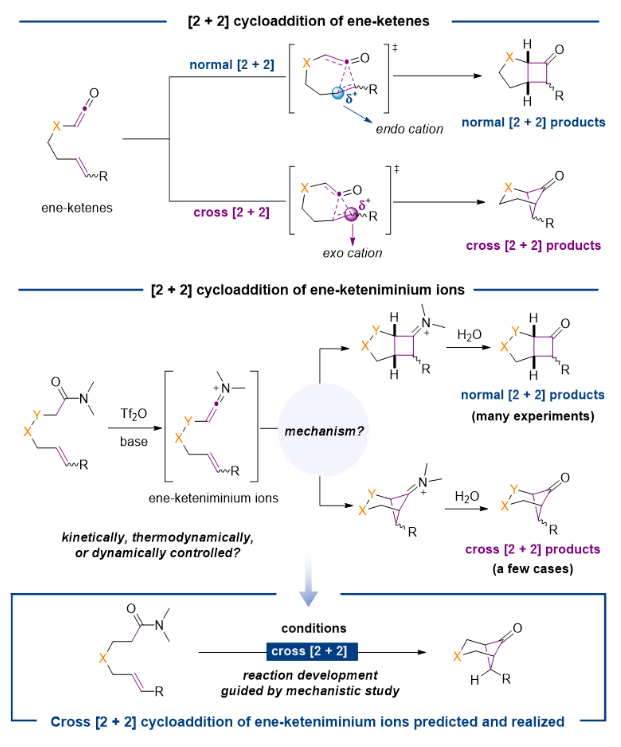
图1. 烯-烯酮和烯-烯酮亚胺正离子的[2+2]环加成反应。图片来源:JACS
该课题组利用高精度的量子化学计算发现,对于带有α-O桥的烯-烯酮亚胺正离子,该反应会先发生环丙烷化生成6/3并环中间体,随后重排生成正常或者交叉[2+2]环加成产物(图2)。当烯烃内侧带有烷基取代基,或者烯烃为末端烯烃时,重排生成正常[2+2]环加成产物的路径比交叉[2+2]环加成路径更为有利,所以会得到正常[2+2]环加成产物,这和实验一致(图2a)。而当烯烃外侧有取代基时,交叉[2+2]环加成路径动力学上更为有利。但是由于交叉[2+2]产物热力学相对不利,其会转化为热力学更为稳定的正常[2+2]或傅-克型产物(图2b)。
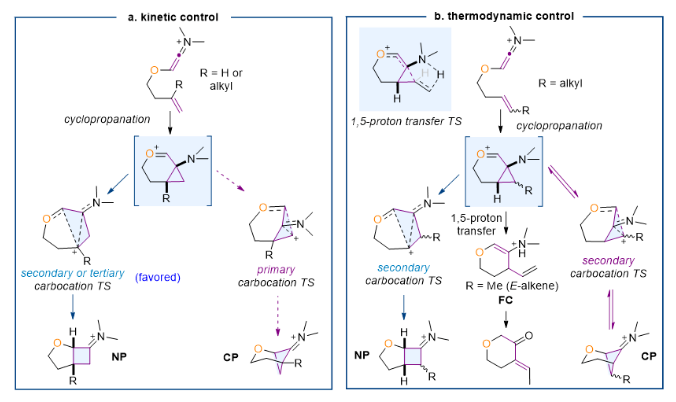
图2. α-O桥烯-烯酮亚胺正离子[2+2]环加成反应的机理。图片来源:JACS
而对于β-N桥的烯-烯酮亚胺正离子,反应机理则完全不同。反应选择性可以是由动力学控制或者动态学控制的。作者结合量子化学计算和准经典轨迹(quasi-classical trajectories)分子动力学模拟的预测和实验验证提出了碳正离子模型以解释反应的选择性(图3)。该反应会经历endo碳正离子生成正常[2+2]环加成产物或者exo碳正离子生成交叉[2+2]产物,反应的选择性由这两种碳正离子的相对稳定性所决定。当endo碳正离子相较于exo碳正离子更为稳定时,反应生成正常[2+2]环加成产物更为有利;当exo碳正离子更为稳定时,反应生成交叉[2+2]环加成产物更为有利;当endo和exo两种碳正离子的稳定性接近时,反应会变为动态学控制,两种产物都能观测到。
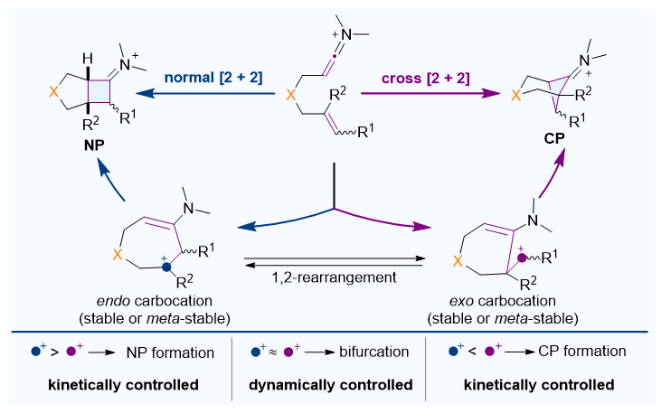
图3. [2+2]环加成反应的碳正离子模型。图片来源:JACS
随后作者利用该模型进行了更多的预测和实验验证。准经典轨迹分子动力学模拟预测烯烃外侧带有甲基的烯-烯酮亚胺正离子1i的[2+2]反应给出正常[2+2]产物和交叉[2+2]产物的比例为1:95(图4a,b),意味着正常[2+2]产物将会几乎观测不到,这与文献中的比例(1:5)存在较大差异。作者重新实验验证了该反应,发现反应没有观测到正常[2+2]产物(图4c),而是产生了另一种交叉[2+2]产物3H,两者比例(3I:3H)也为5:1。经过分析,作者发现利用文献方法合成出的底物是E/Z混合物(图4),由此可以认为该产物3H是由底物中的Z式部分转化而来的。于是作者预测提高底物的E/Z值将可以实现交叉[2+2]反应。实验上作者利用一种新方法合成了E/Z为11:1的底物1I',发现3I:3H提高到了19:1,再次证实了理论预测。在以上预测的指导下,作者进一步发现底物烯烃外侧带有trans烷基取代基都能高选择性地发生交叉[2+2]环加成反应,例如1J和1K。末端带有二甲基取代的1L则会发生1,5-质子转移生成傅-克型产物4L。
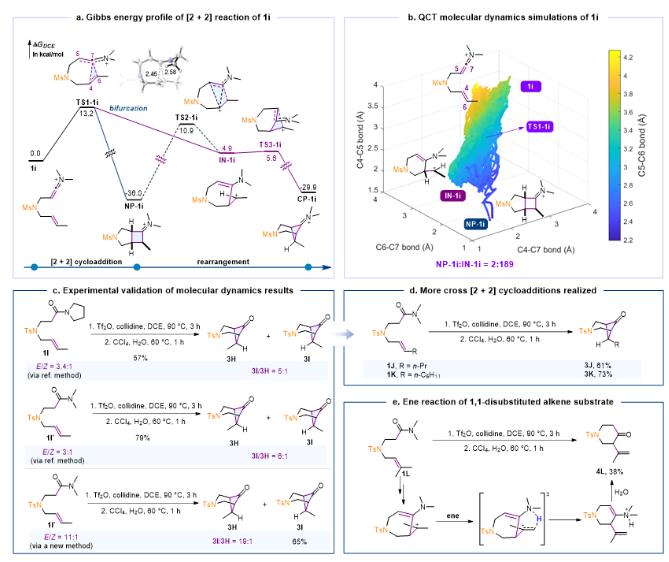
图4. 计算和实验对文献中错误结构的纠正和交叉[2+2]环加成反应的发展。图片来源:JACS
当烯-烯酮亚胺正离子的烯烃外侧带有trans芳基取代的时候,作者根据模型预测该反应的选择性会变为动力学控制,并且会选择性地发生交叉[2+2]环加成反应。理论计算和实验都支持了该预测,不同的芳基取代甚至改变桥连基团都能得到交叉[2+2]环加成产物(1M、1N和1O)。带有Z式芳基的烯-烯酮亚胺正离子的[2+2]反应是动态学控制的,实验上得到了交叉[2+2]产物3P和经历碳碳键旋转后的交叉[2+2]产物3M。
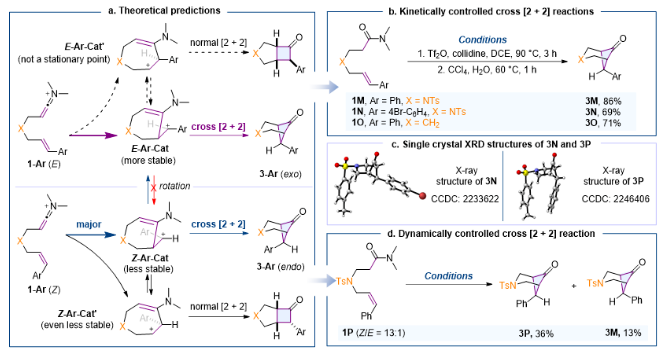
图5. 芳基取代烯-烯酮亚胺正离子交叉[2+2]环加成反应的预测和验证。图片来源:JACS
总结
余志祥课题组结合计算化学与实验验证,发现了动力学控制、热力学控制和动态学控制三种选择性控制模式同时存在于烯-烯酮亚胺正离子分子内[2+2]环加成反应中(图6)。同时,他们提出了一个碳正离子模型以解释该反应的选择性。在该模型的指导下,该课题组成功实现了之前很难实现的选择性交叉[2+2]环加成反应,可以合成药物化学中较为重要的生物电子等排体双环[3.1.1]庚烷骨架。理论计算和实验也更正了前人文献中报道的一个[2+2]产物的结构,进一步支持了该课题组所提出机理的合理性。
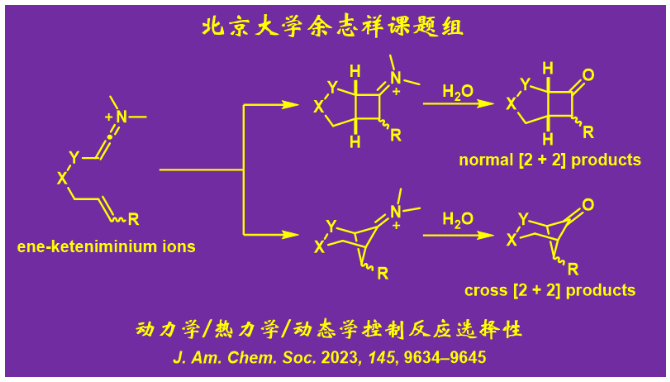
图6. 具有动力学/热力学/动态学三种反应选择性控制模式的烯-烯酮亚胺正离子[2+2]环加成反应
本文的工作在余志祥教授指导下由课题组的博士研究生张攀完成。感谢国家自然科学基金委员会的资助和北京大学高性能计算平台的支持。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn