

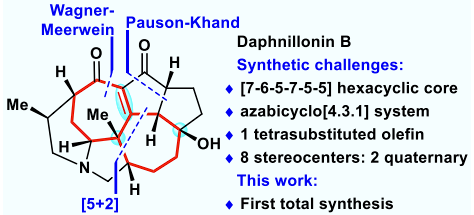
虎皮楠生物碱是分离自虎皮楠属植物的一大类天然产物生物碱,其新颖独特的化学结构和丰富多样的生物活性吸引了大批科学家对其合成发起挑战,是全合成领域的研究热点之一。到目前为止已经有十余个课题组报道了虎皮楠生物碱的全合成工作。如图1所示,此前实现全合成的虎皮楠生物碱大多含有的是[6-7]并环体系;含有[7-7]并环体系的daphnicyclidin类虎皮楠生物碱是特殊的一类,含有二十多个成员,并且表现出一定的生物活性。目前已经有多个课题组对该类虎皮楠生物碱的合成发起挑战。Daphnillonin B是由岳建民课题组于2019年分离,是daphnicyclidin类虎皮楠生物碱的成员之一;在结构上,其含有新颖的[7-6-5-7-5-5]六环骨架,同时包含一个氮杂[4.3.1]桥环体系,一个四取代双键和八个手性中心,其中两个是季碳中心,在合成上极具挑战性。在此之前,没有全合成报道。
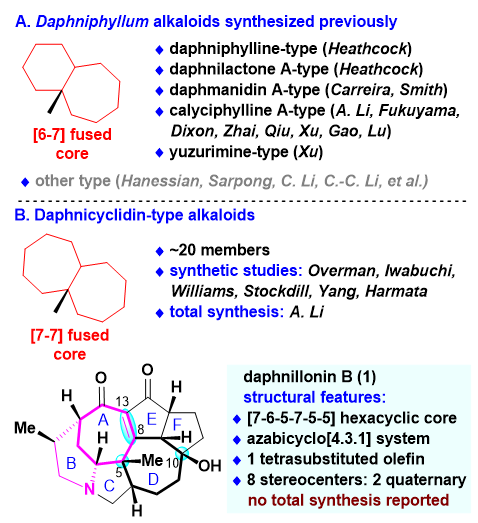
图1. Daphnillonin B的背景介绍。图片来源:JACS
李闯创课题组的合成设计如图2所示,天然产物daphnillonin B可以由化合物2经过后期的氧化态调整获得,含有[7-7]并环结构的化合物2可以通过[6-7]并环骨架化合物3经过重排生成,化合物3的E/F五五环可以由化合物4经过分子内的Pauson-Khand反应一步构建,化合4的B桥环可以通过自由基环化策略从化合物5构建,而化合物5可以逆推至三环骨架化合物6,三环骨架化合物6中的C/D环可以通过化合物7经过Type I [5+2]环加成反应构建,化合物7可以由羟基片段8和呋喃片段9经过Mitsunobu反应和Achmatowicz重排反应构建。
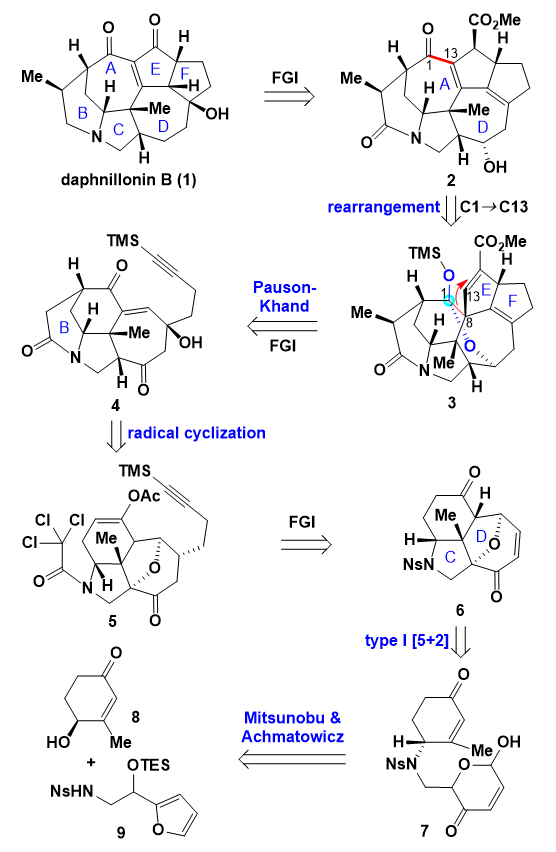
图2. 逆合成分析。图片来源:JACS
具体合成路线如图3所示,从商业易得的邻甲酚10出发,在高价碘氧化剂PIFA和新戊二醇11的作用下,邻甲酚发生氧化去芳构化生成化合物12,随后采用Wikinson催化剂选择性还原其中取代基少的双键生成烯酮化合物13。氢化铝锂还原化合物13的羰基构建了羟基片段14,紧接着羟基片段和呋喃片段9在PPh3和DIAD的作用下发生Mitsunobu反应,随后在TBAF的作用下脱除硅保护基,以70%的收率获得了化合物15。化合物15在NBS的作用下,羟基呋喃发生Achmatowicz重排,同时在盐酸的作用下缩酮发生水解,以77%生成了化合物7。获得化合物7以后,作者在羟基上引入Boc基团,随后在三乙胺的作用下,顺利发生[5+2]环加成反应,以77%的收率获得了三环化合物6,其结构通过单晶衍射确认。获得化合物6以后,在氰化亚铜的作用下,格氏试剂16转化为铜试剂,通过Michael加成引入炔基侧链,随后在碳酸钾和对甲基苯硫酚的作用下,硝基磺酰基脱除生成二级胺,紧接着和酰氯反应引入三氯乙酰基侧链生成化合物17。获得化合物17以后,羰基在对甲苯磺酸和乙酸异丙烯酯的条件下发生酯交换,选择性的在六元环上的羰基上引入乙酸烯醇酯,以85%的收率顺利构建了关环前体化合物5。化合物5在Grubbs二代催化剂的作用下,发生原子转移的自由基环化反应,顺利构建了分子中的哌啶桥环,随后在AIBN和硅氢的作用下氯原子脱除,以55%的收率获得了化合物18,其结构通过单晶衍射确认。紧接着,化合物18在二碘化钐的作用下,氧桥打开,随后在对甲苯磺酸的作用下羟基发生消除生成烯酮,烯酮在三乙胺的作用下与氧气反应并用亚磷酸三乙酯切断过氧键,顺利在C10位引入羟基,生成化合物4。化合物4在Co2(CO)8和乙腈回流的作用下,Pauson-Khand反应顺利发生,同时采用ICl切断碳硅键,以65%的收率构建了六环体系化合物19,其结构通过单晶衍射确认。值得注意的是,化合物19含有calyciphylline A类虎皮楠生物碱的[6-6-5-7-5-5]全部六环骨架,是构建calyciphylline A类虎皮楠生物碱的潜在中间体。
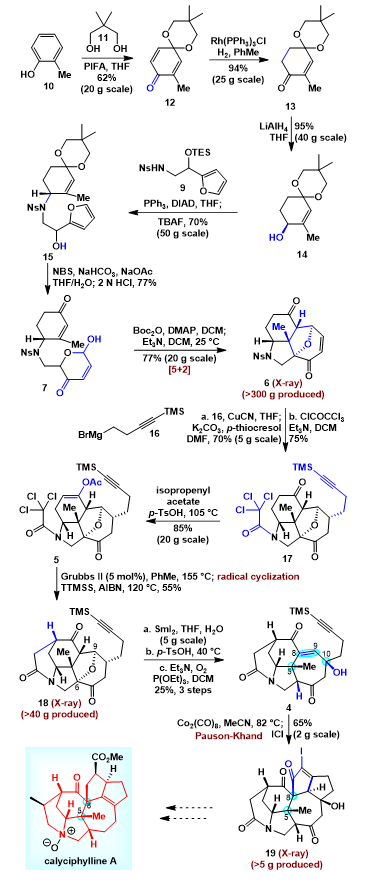
图3. 六环骨架中间体19的合成。图片来源:JACS
如图4所示,获得中间体19以后,作者先将三级羟基消除引入四取代双键,随后DIBAL-H的作用下,七元环的羰基发生消除,生成的羟基和六元环上的羰基作用生成半缩酮,同时用TMS将半缩酮上的羟基保护生成了化合物20。随后在钯催化剂的作用下,烯基碘发生插羰反应引入甲酯侧链,紧接着在硼氢化锂的作用下,发生选择性的1,4还原和1,2还原,以74%的收率生成化合物21。获得化合物21以后,作者首先尝试通过C13羟基的消除来构建化合物3,前期的尝试并没有成功,随后作者将化合物21的羟基转化为黄原酸酯生成化合物22;经过尝试,作者发现化合物22在二氯苯中加热的条件下,发生Wagner-Meerwein类型的重排反应,以88%的收率生成了化合物23,其结构通过单晶衍射确认。随后,通过Chugaev消除拿掉C12羟基,生成化合物24。化合物24经过钯碳氢化双键,随后在mCPBA的作用下四取代双键发生环氧化,以60%的收率获得了化合物25。紧接着,在二碘化钐的作用下环氧打开生成化合物26。获得化合物26以后,在氢氧化锂的作用下甲酯水解,随后在mCPBA和DCC的作用下,发生羧基转化反应生成化合物27。最后选择性还原酰胺羰基,水解酯基,然后将羟基氧化为羰基,顺利实现了daphnillonin B的消旋体的合成。
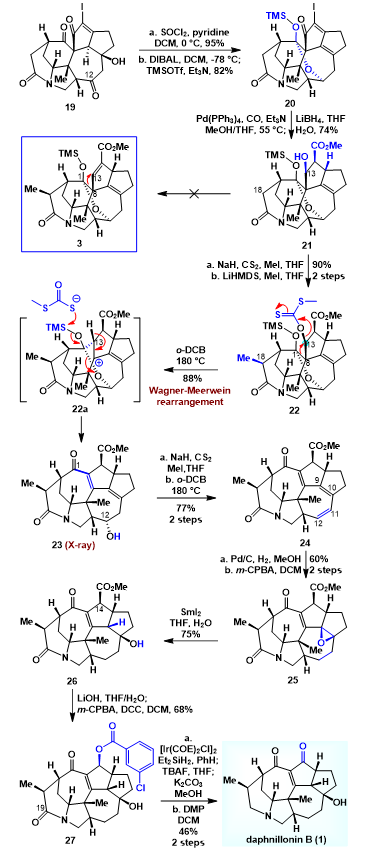
图4. Daphnillonin B的全合成。图片来源:JACS
如图5所示,在完成daphnillonin B的消旋体的全合成后,作者对其不对称合成进行了探索。化合物13经过经典的Corey−Bakshi−Shibata反应引入关键手性中心,以96%的ee值构建了手性醇片段(-)-14。随后按照既定的路线,成功实现了daphnillonin B的不对称合成。合成的天然产物的比旋光值与分离报道的比旋光值一致,从而毫无争议的确证了天然产物的绝对构型。
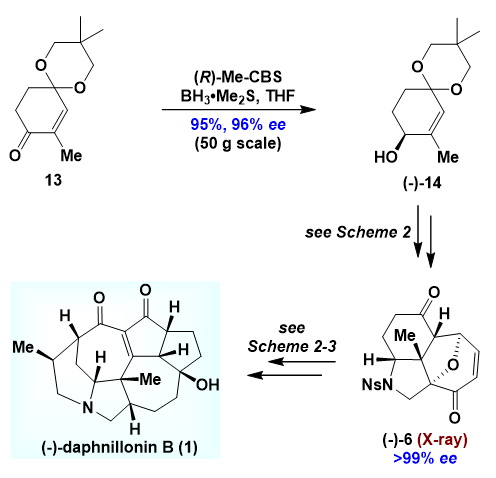
图5. Daphnillonin B的不对称全合成
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn