

(图片来源:Nat. Catal.)
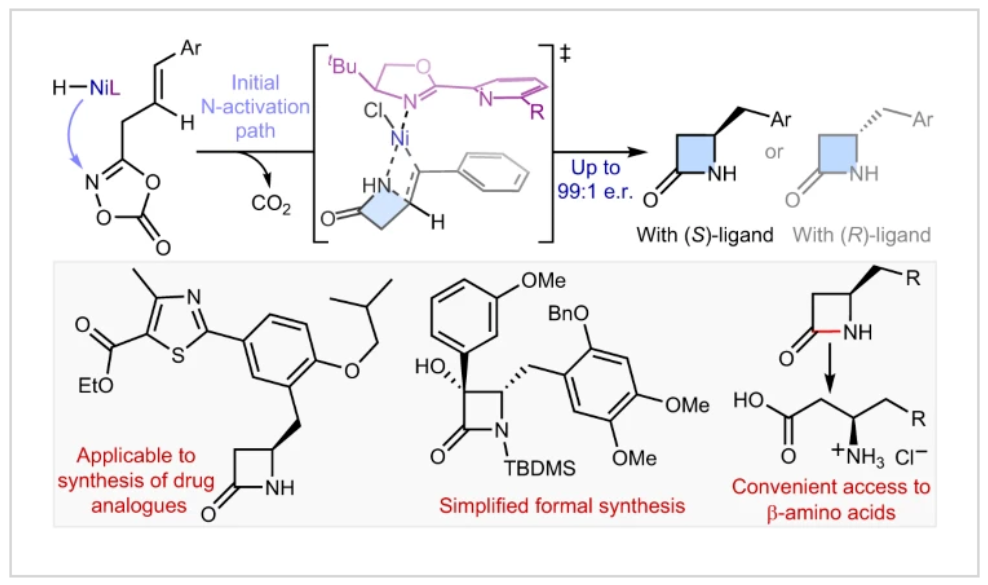
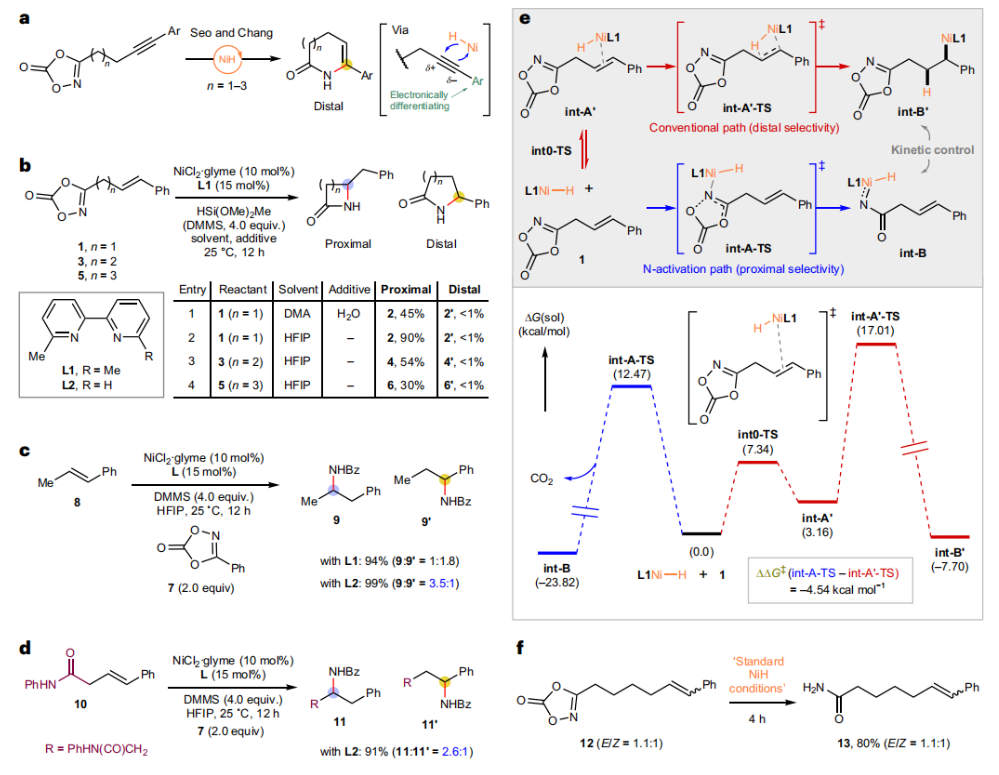
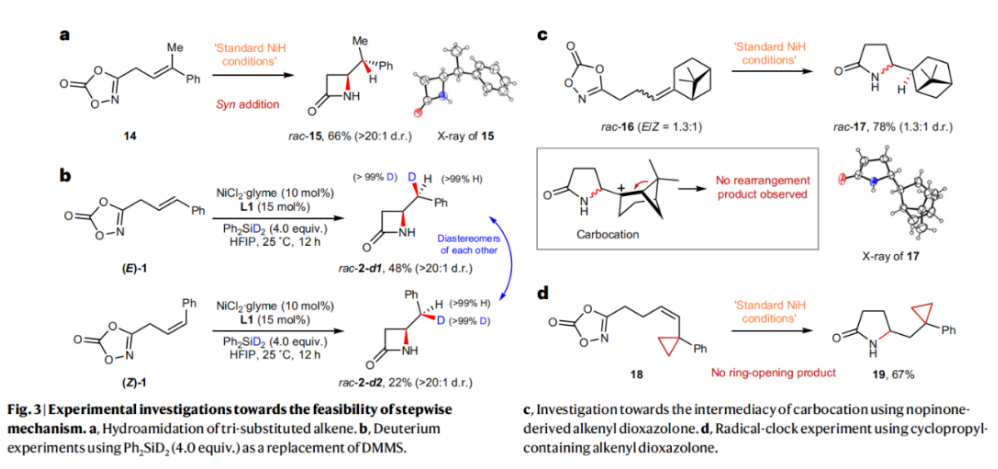
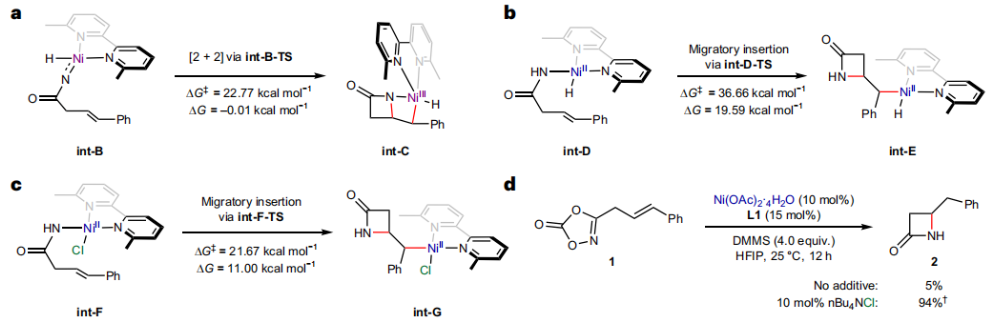
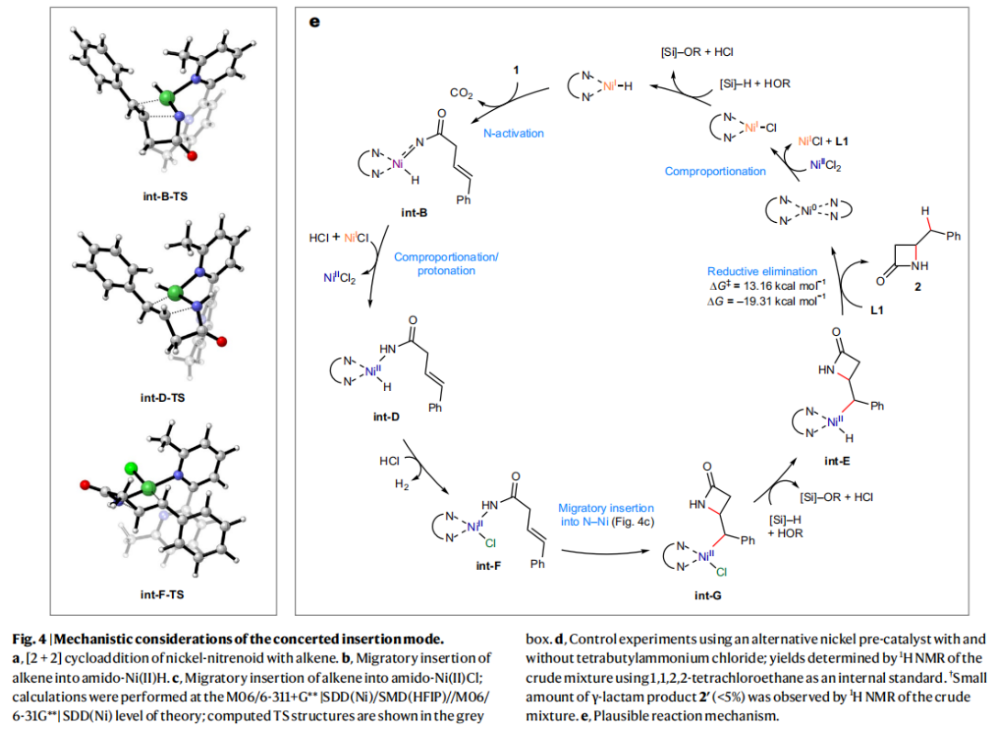
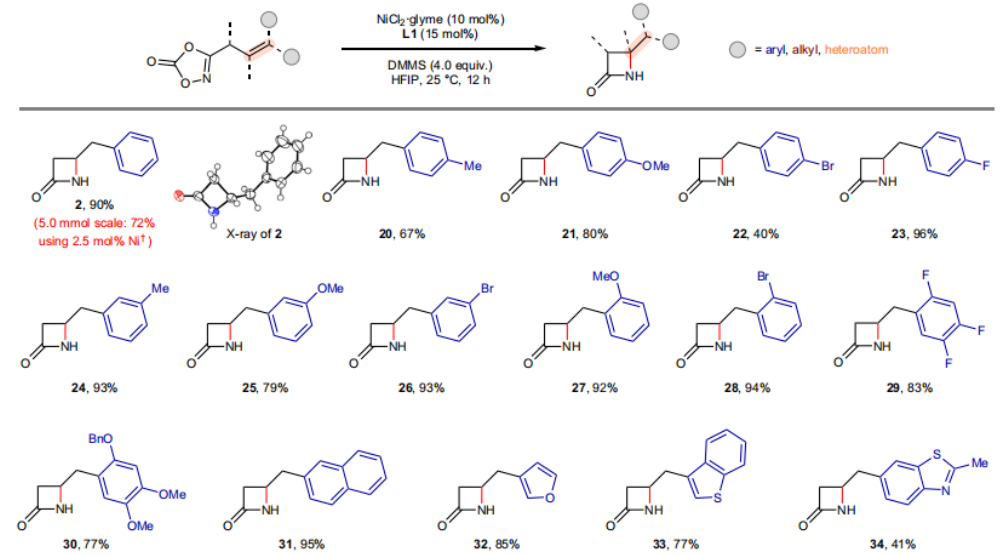
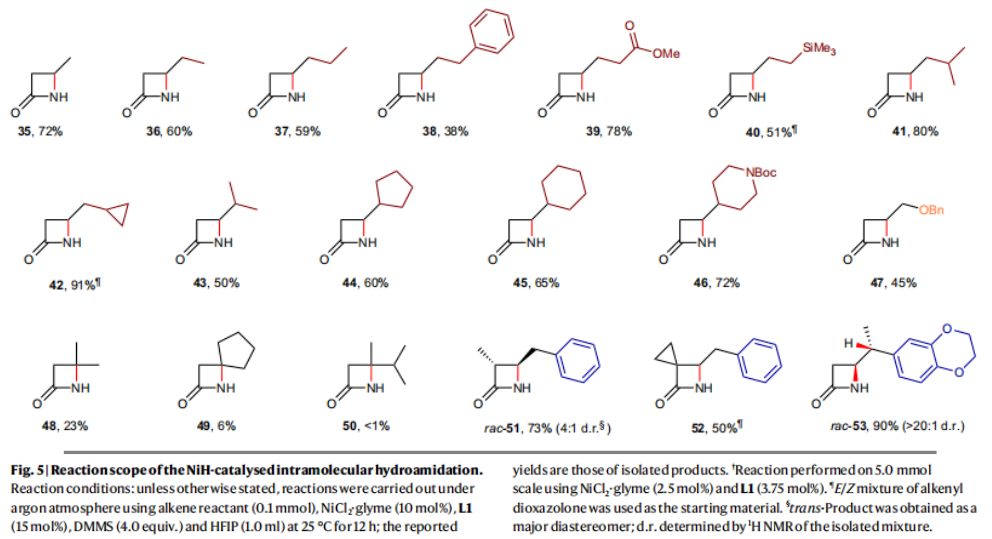
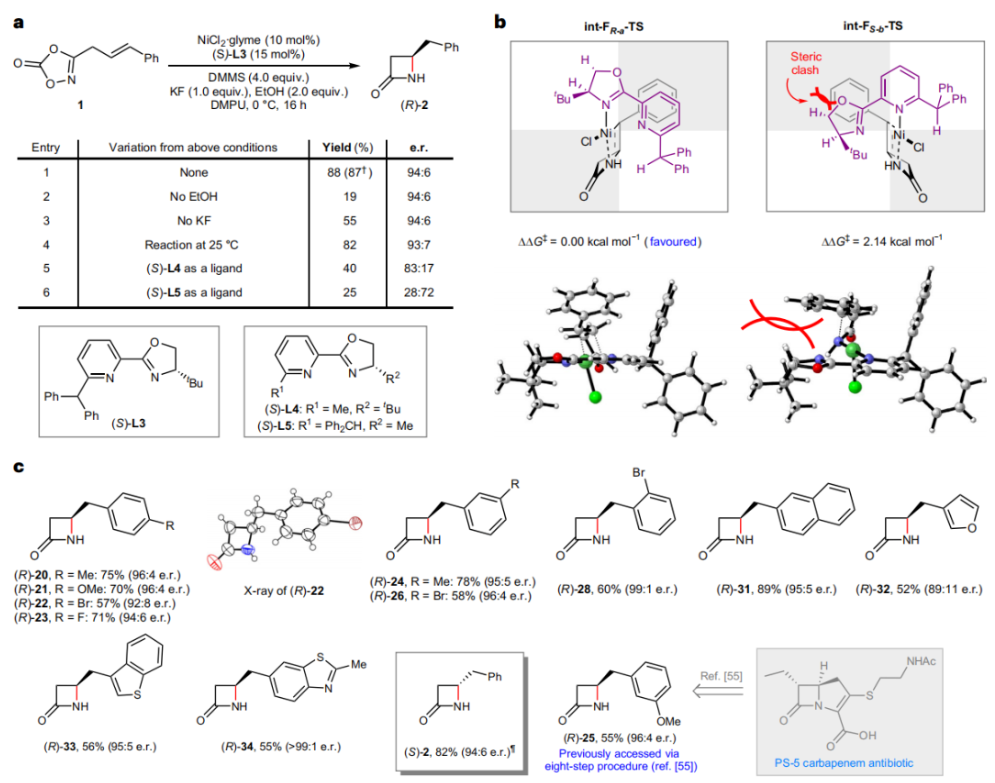
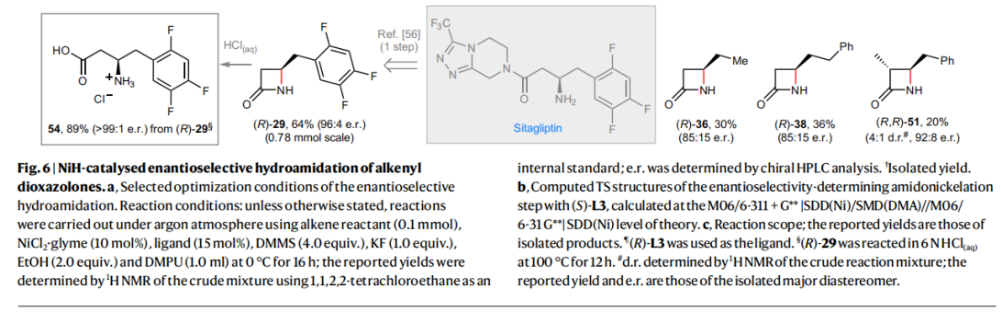
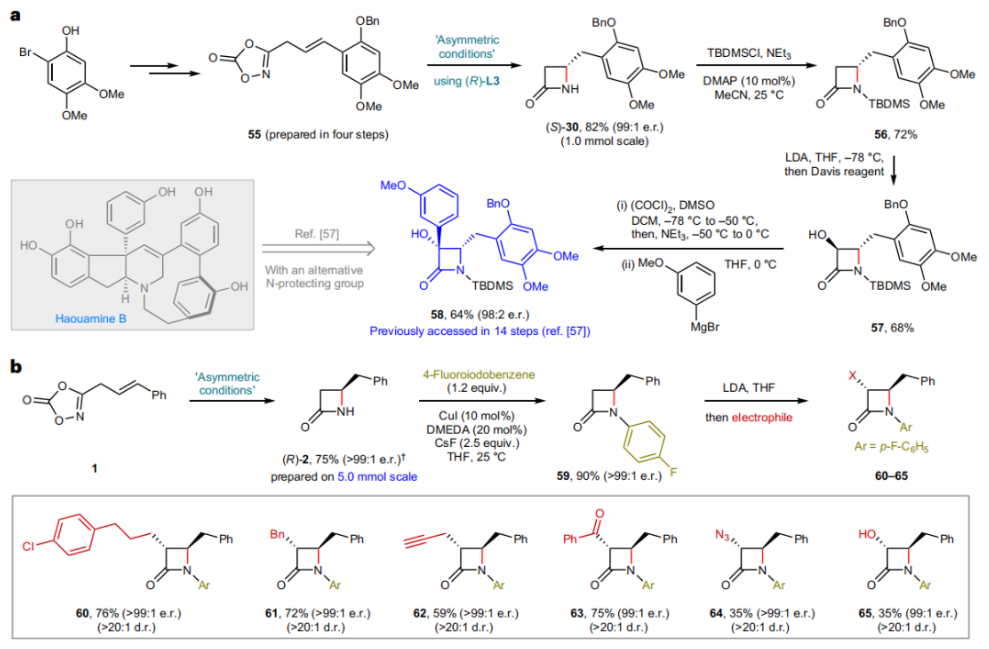
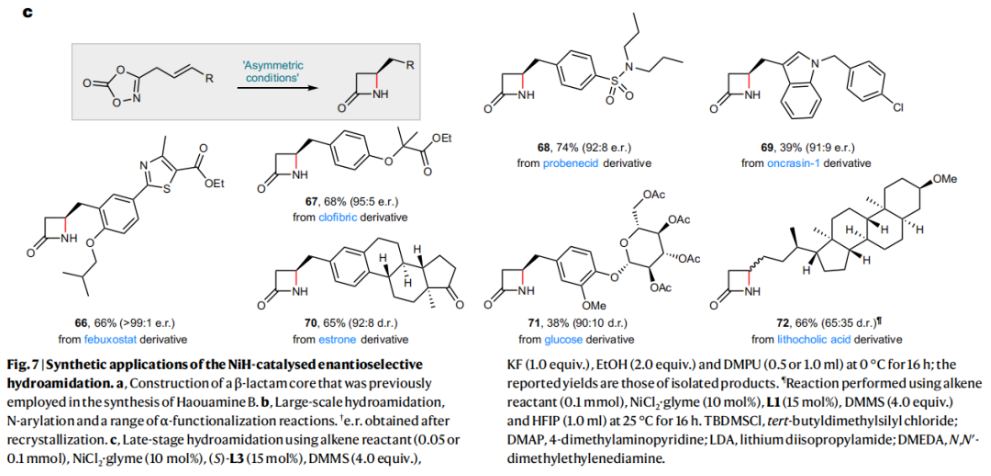
正文 由于β-内酰胺在青霉素类和碳青霉烯类抗生素等生物活性化合物中广泛存在,因此发展对映体富集的β-内酰胺合成方法是至关重要的。虽然β, γ-不饱和酰胺的分子内氢-酰胺化为β-内酰胺的合成提供一种方便的方法,但由于具有较高张力的四元环难以形成所引起的区域选择性问题,使其在合成中的应用受到极大的限制。最近,Sangwon Seo与Sukbok Chang课题组联合发展了NiH催化策略,高区域选择性的实现了烯基二噁唑酮衍生物的分子内氢-酰胺化反应,选择性构建了一系列β-内酰胺(Fig. 1)。下载化学加APP到你手机,更加方便,更多收获。 (图片来源:Nat. Catal.) 首先,作者选择烯基二噁唑酮1作为模板底物进行反应探索(Fig. 2)。通过一系列条件筛选,作者发现当使用NiCl2·glyme (10 mol%), L1 (15 mol%), DMMS(dimethoxy(methyl)silane)(4.0 equiv.),在HFIP中25 °C反应12小时可以以90%的产率专一的得到β-内酰胺产物2。此外,当使用延长碳链的原料3或5反应时,仍可以分别以54%和30%的产率得到γ-内酰胺4和δ-内酰胺产物6。通常来讲,γ-内酰胺2’ 应该为此类转化的主要产物,而构建β-内酰胺产物则相对比较困难。为了深入理解此转化的区域选择性,作者进行了一系列控制实验和DFT计算并得出如下结论:1)在目前的催化体系中,导向效应是微不足道的;2)与共轭芳基取代基所引起的电子扰动相比,二噁唑酮官能团的诱导效应即使存在,也只是微不足道的;3)作者认为β-内酰胺2可能通过一种涉及N-活化的途径获得;4)Ni(I)H活化二噁唑酮所需的能量比氢-镍化过程要低(ΔΔG‡= -4.54 kcal mol-1,配体= L1),从而得到NiH中间体(int-B),该中间体随后实现了近端的C-N键构建。 (图片来源:Nat. Catal.) 基于提出的N-活化为此转化的主要起始途径,作者通过控制实验对后续的反应过程进行了探索(Fig. 3)。在标准条件下,当使用三取代烯烃14进行氢-酰胺化反应时,氮和氢通过专一的顺式加成,以66%的产率,>20:1 dr得到相应的β-内酰胺产物rac-15,这与逐步加成机理通常具有较低非对映选择性相冲突(Fig. 3a)。类似的,当使用Ph2SiD2代替DMMS进行氘代实验时,无论使用(E)-1还是(Z)-1均可以得到相应的β-内酰胺产物rac-2-d1(48%)和rac-2-d2(22%)。此外,当使用Nopinone取代的烯基二噁唑酮 rac-16和环丙基取代的烯基二噁唑酮18参与反应时,可以分别以78%和67%的产率得到唯一产物rac-17和19,且并未观察到重排产物生成,由此排除了反应中涉及碳正离子中间体和自由基中间体的可能性(Fig. 3c,d)。 (图片来源:Nat. Catal.) 基于上述实验结果和计算结果,作者提出了此转化可能的反应机理(Fig. 4)。镍氢物种通过氮活化得到int-B; 随后int-B通过归中/质子化以及配体取代过程得到int-F; 接下来,int-F经历N-Ni插入双键和配体交换得到烷基-NiH中间体int-E;最后int-E通过还原消除(ΔG‡ = 13.16 kcal mol−1 , ΔG = −19.31 kcal mol−1)得到β-内酰胺产物2和Ni(0)物种。 (图片来源:Nat. Catal.) 在深入理解了此转化不同寻常的区域选择性后,作者对此NiH-催化的分子内氢-酰胺化反应的底物范围进行了探索(Fig. 5)。实验结果表明,一系列(杂)芳基取代的烯烃均可顺利兼容此转化,以41-96%的产率得到相应的产物2-34。此外,此转化对端炔以及烷基取代的烯烃同样具有良好的兼容性,以38-91%的产率得到相应的β-内酰胺产物35-47, 51-53。当在C-N键形成的碳上增加取代基对反应效率不利,仅分别以23%,6%,<1%的产率得到产物48, 49和50。 (图片来源:Nat. Catal.) 接下来,作者对此转化的不对称诱导过程进行了探索(Fig. 6)。当使用NiCl2·glyme (10 mol%), Pyox 配体 (S)-L3 (15 mol%),DMMS (4.0 equiv.), KF (1.0 equiv.), EtOH (2.0 equiv.),在DMPU(N,N’-dimethylpropylene urea)中0 °C反应16小时可以以88%的产率,94:6的er得到(R)-2。此外,作者通过DFT计算对此环化的不对称诱导过程进行了计算。最后,作者对此不对称诱导过程的底物范围进行了考察。实验结果表明此体系对不同取代的底物具有良好的适用性,以52-89%的产率,99:1-89:11的er得到相应的产物(R)-20-(R)-24,(R)-26,(R)-28,(R)-31-(R)-34。值得注意的是,利用此策略仅通过4步即可实现(+)-PS-5 碳青霉烯抗生素(carbapenem antibiotic)的形式合成关键中间体,而之前文献报道的过程(Synlett, 1992, 35)则需要8步。此外,利用此策略还可以实现Sitagliptin全合成过程所需的关键中间产物(R)-29(64%, 96:4 dr)的合成。 (图片来源:Nat. Catal.) 最后,作者探索了所发展的分子内对映选择性氢-酰胺化反应的合成应用(Fig. 7)。首先,作者通过四步合成得到了烯基二噁唑酮衍生物55,并通过所发展的对映选择性氢-酰胺化反应,以82%的产率得到(S)-β-内酰胺产物(S)-30(1.0 mmol 规模)。而(S)-30则可以通过N-TBDMS保护、α-羟基化、Swern氧化、格氏试剂加成得到多官能团化的β-内酰胺58。利用58则可以利用文献报道的方法(Angew. Chem. Int. Ed., 2014, 53, 13215)实现Haouamine B的合成(Fig. 7a)。接下来,作者利用1作为起始原料,将反应放大至5.0 mmol规模时仍可以以75%的产率得到β-内酰胺产物(R)-2(>99:1 er)。(R)-2在经历了铜催化的N-芳基化反应后可以以90%的产率得到N-芳基-β-内酰胺产物59(>99:1 er)。随后,在LDA的存在下,59与一系列亲电试剂反应,实现了α-位的官能团化,以35-76%的产率得到相应的产物α-烷基化、苄基化、炔基化、苯甲酰基化、叠氮化、羟基化产物60-65,且ee值可以得到保持(Fig. 7b)。最后,作者对一系列复杂生物活性分子的兼容性进行了考察(Fig. 7c)。包括febuxostat (66), clofibric (67), probenecid (68), oncrasin-1 (69), estrone (70) 和glucose (71)在内的药物和天然产物分子均可兼容此不对称氢-酰胺化反应,以38-74%的产率得到相应的β-内酰胺产物66-71。 (图片来源:Nat. Catal.) 总结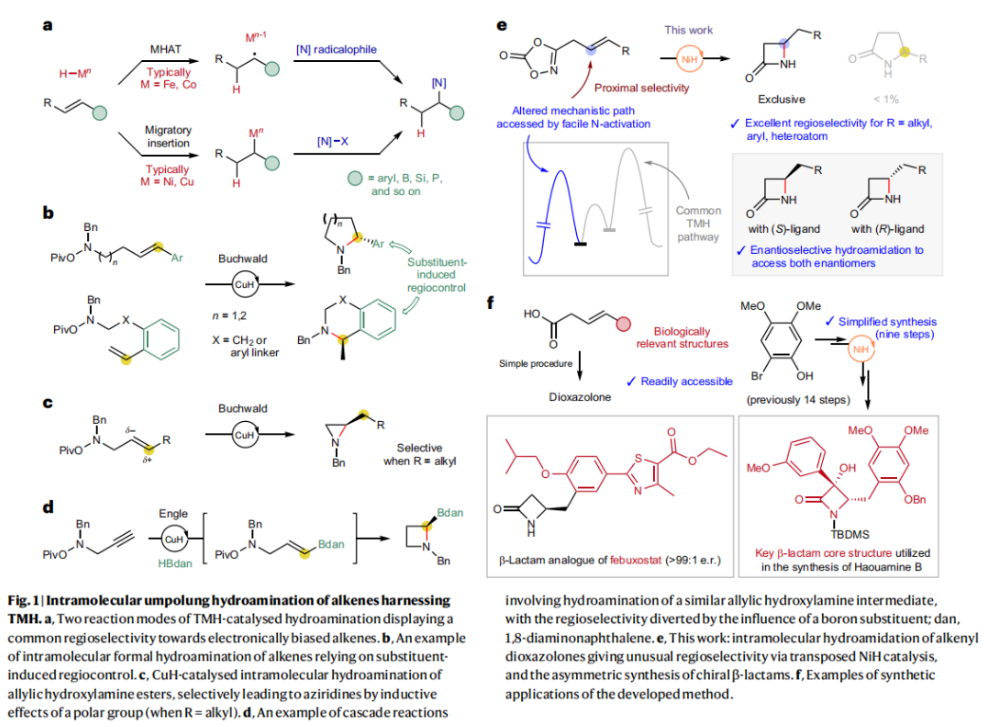

声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn