- 首页
- 资讯
JACS:Tobias Ritter课题组喹啉的选择性C-H氟化
来源:化学加原创 2023-09-25
导读:近日,德国马克斯-普朗克研究所Tobias Ritter课题组报道了一种新型的C-H亲核氟化策略,涉及异步协同式(asynchronous concerted)F−-e−-H+转移的链过程而不是形成氮杂芳烃Meisenheimer中间体的过程。同时,利用协同亲核芳香取代策略,首次实现了喹啉衍生物的亲核氧化氟化反应。文章链接DOI:10.1021/jacs.3c07119
(图片来源:J. Am. Chem. Soc.)
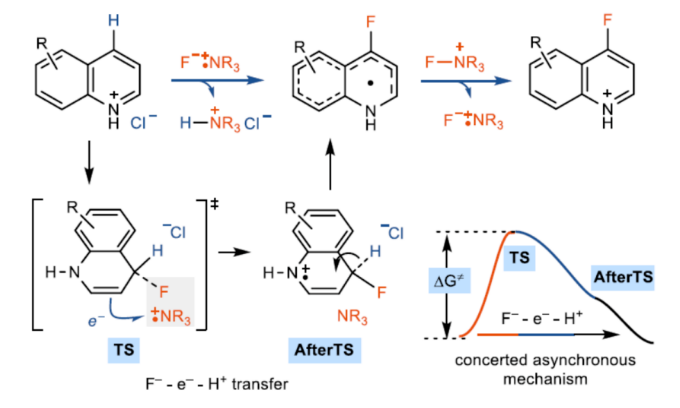
芳香族C-H键到C-F键的单步转化是一种极具吸引力的方法,该方法无需进行预官能团化操作即可获得具有价值的氟化产物,这些氟化产物广泛应用于药物和材料化学中。然而,对于官能团化分子的选择性芳香族C-H键的氟化却较少有相关的报道,部分原因是氟的高电负性和氟的小离子半径导致了与C-F键形成相关反应的能垒很高,从而使金属氟化物的还原消除变得困难。因此,芳香族C-H的氟化,迄今为止只有少数成功的例子。其中,六元氮杂芳烃的氟化更具挑战性,目前尚未实现C4-选择性氟化反应。缺电子的氮杂芳烃上的sp2-杂化氮原子使亲电芳香取代(SEAr)变得困难,主要是由于形成高度不稳定的潜在Wheland中间体(Figure 1a)。氮杂芳烃的自由基芳香取代,如Minisci-型反应,可以构建C-C、C-B和C-Si键,但不能构建C-F键。亲核氟化是具有挑战性的,因为在氟化物加成形成Meisenheimer中间体后,必须除去氢化物后再进行再芳构化。此外,氟化物Meisenheimer中间体的形成对氮杂芳烃是有利的(Figure 1b),这将需要容易地消除氢化物,这样整体能垒就不会太大。到目前为止,只有通过AgF2-介导的Chichibabin-型反应实现了C2-选择性氟化(Figure 1c)。虽然六元氮杂芳烃的C4-位是最具亲电性,但该位置的C-H氟化尚未完成。近日,德国马克斯-普朗克研究所Tobias Ritter课题组报道了一种新型喹啉衍生物的C-H氟化反应,且避免了Meisenheimer中间体的形成(Figure 1d)。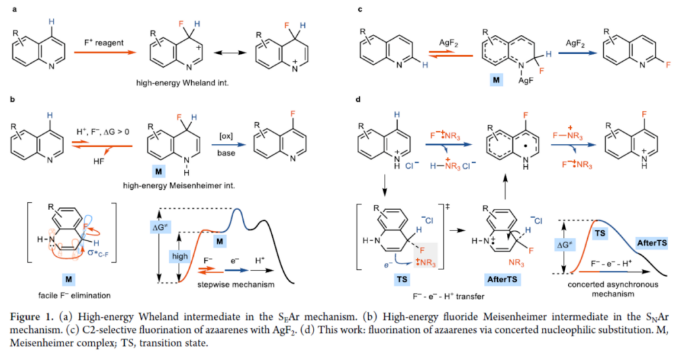
Meisenheimer 配合物通常是SNAr反应的中间体。然而,在协同亲核芳香取代(CSNAr)中,Meisenheimer配合物是过渡态,在这种情况下避免了高能中间体的形成。因此,CSNAr氟化可以提供机会来避免与从高能的Meisenheimer配合物中消除氢化物相关高能垒,以实现氮杂芳烃C-H氟化。因此,Ritter课题组试图在质子化喹啉附近生成离子对TEDA2+•F−(TEDA,N-(氯甲基)三乙烯二胺),用于潜在的协同F−-e−转移,同时进行去质子化(Figure 2a,链传播)。前期,Ritter课题组利用双阳离子自由基TEDA2+•的高电子亲和力进行了电荷转移导向的自由基取代。因此,Ritter课题组设想TEDA2+•F−可能支持F−-e−-H+转移(Figure 2a,A→D),然后在F−进攻和C-H断裂后,中间体进一步单电子氧化时,e−转移(D→A)链用于C-H氟化。在这种情况下,可以避免质子化Meisenheimer中间体的形成,并且具有挑战性的氟化也变得可行。Ar-H + Selectfluor → Ar-F + TEDA-H2+的整体双电子反应,将通过两个单电子氧化还原过程和ET来实现,以维持链过程。Selectfluor通过单电子还原引发链生成用于链传播的TEDA2+•F−离子对,需要满足以下条件:电子供体足够强,可以在酸性条件下还原Selectfluor以生成足够高浓度的TEDA2+•,并且电子供体不应与Selectfluor发生其它的副反应。满足这两个要求的合适配合物可能是质子化的氮杂芳烃本身的还原态,即N-杂环π-自由基F(Figure 2a,链引发)。同时,电子供体F可以向Selectfluor提供电子,以生成用于链传播的TEDA2+•F−。激发态质子化的氮杂芳烃E可能源于基态质子化氮杂芳烃和三重态光敏剂(PS)之间的能量转移(EnT)。为了有效地进行EnT,Ritter课题组选择呫吨酮(xanthone)作为光敏剂,HCl和Et3N·HCl分别用作H+和Cl−供体时,在用365 nm LED照射时,可以56%的收率得到C4-氟化喹啉衍生物2(Figure 2b)。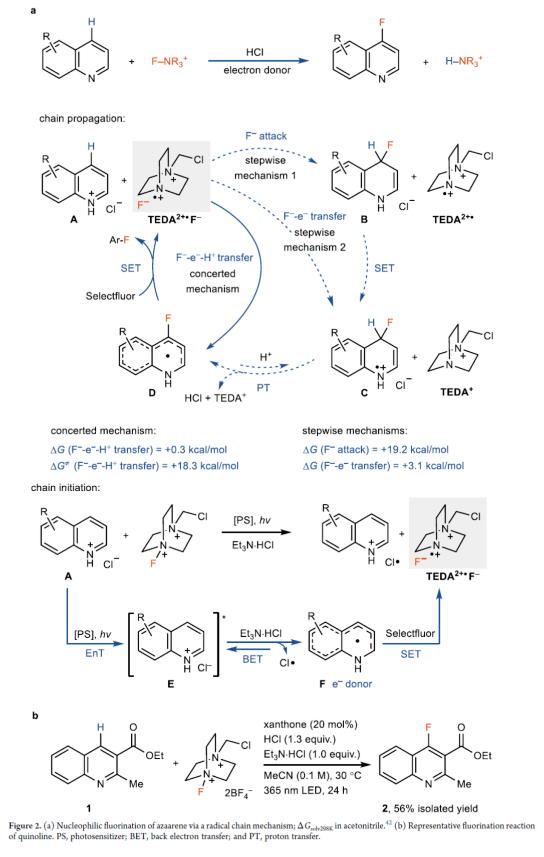
协同机理。在引发生成TEDA2+•F−时,氟化物偶联的电子转移到质子化的喹啉A,同时去质子化,可生成中间体D(Figure 2a,链传播)。富电子的π-自由基D可以被Selectfluor氧化形成氟化产物,并再生TEDA2+•F−。分步机理1。TEDA2+•F−的氟化物可以进攻喹啉盐酸盐A形成Meisenheimer中间体B和TEDA2+·,中间体B可进行ET-PT或HAT(A→B→D)。中间体B和TEDA2+•之间反应的ET活化能表明,Meisenheimer中间体B和TEDA2+•不太可能形成稳定的配合物(Figure 3a)。内部反应坐标(IRC)分析表明,TEDA2+•F−的过渡态进攻喹啉盐酸盐A以及经ET后,可直接生成产物,从而排除了沿反应路径存在额外的最大值(Figure 3b)。过渡态的自然键轨道分析(NBO)表明,在C-F键形成过程中存在一个显著的电荷转移过程(Figure 3b)。中间体B的计算HOMO(Figure 3a, bottom)表明,氟化物和烯胺单元对远离质子供体的HOMO有主要贡献。缺乏来自C-H键的HOMO贡献表明,对于传统的HAT途径来说,C-H断裂是困难的,这需要H+和e−来自同一供体基团。分步机理2。氟化物偶联的电子转移机理形成二氢喹啉自由基阳离子C和TEDA+的配合物,然后进行第二步去质子化(A→C→D),也可能是可行的。然而,KIE实验表明,协同的F−-e−-H+机理(A→D)或分步机理(A→C→D)具有可逆的去质子化。根据计算,当Cl−或TEDA+用作质子受体时,去质子化在没有显著能垒的情况下进行(Figure 3d),这与从A到D的异步协同F−-e−-H+转移机理一致。链引发。氟化反应效率与光敏剂的ET相关,但与它们的还原电位无关,这与形成质子化喹啉的三重态的EnT过程一致(Figure 3e)。对照实验表明,Cl−平衡阴离子和Et3N·HCl添加剂在提高反应收率方面发挥了重要作用(Figure 3f),这可能表明Cl−对质子化喹啉的三重态有进一步的还原淬灭的作用。分子间自由基捕获实验表明,反应形成了氯自由基。电化学研究表明,添加剂Et3N·HCl不能被基态质子化喹啉氧化。然而,用Et3N·HCl还原激发态质子化喹啉是可行的。氟化的量子产率为3.5%,与N-杂环π-自由基F和Cl·之间的反向ET(BET)一致。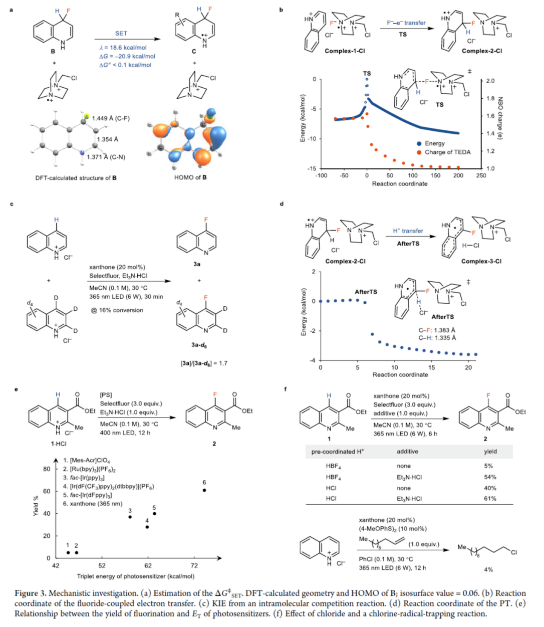
随后,作者对底物范围进行了扩展(Figure 4)。首先,一系列不同取代的喹啉衍生物,均可顺利进行反应,获得相应的产物4-24,收率为30-70%。其次,吡啶衍生物,也是合适的底物,获得相应的产物25-26,收率为30-45%。此外,该策略还可用于复杂分子的后期衍生化,获得相应的产物27-28,收率为21-49%。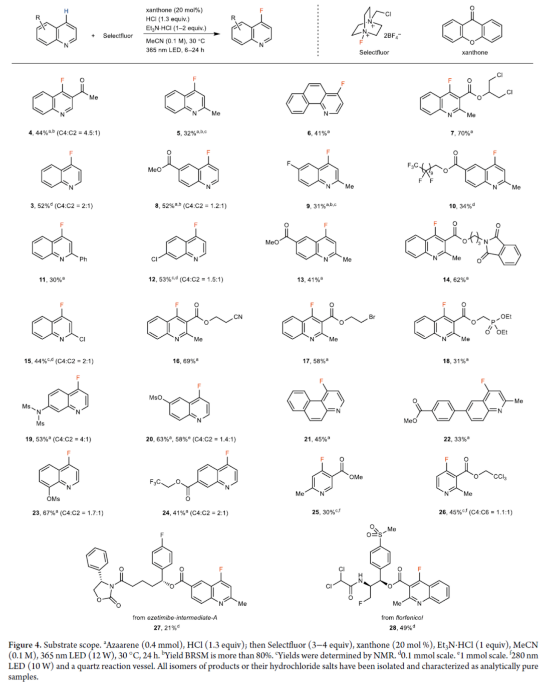
(图片来源:J. Am. Chem. Soc.)
德国马克斯-普朗克研究所Tobias Ritter课题组开发了一种电子转移促进协同亲核芳香取代的策略,提供了一种新型的氮杂芳烃C-H氟化的方法。同时,该策略证明了离子偶联电子转移是如何避免Meisenheimer中间体的形成。因此,该方法可以为离子转移与氧化还原过程的偶联设计提供一个假设,这可能为其它亲核芳香族C-H功能化提供新的机理基础。文献详情:
Li Zhang, Jiyao Yan, Dilgam Ahmadli, Zikuan Wang, Tobias Ritter*. Electron-Transfer-Enabled Concerted Nucleophilic Fluorination of Azaarenes: Selective C−H Fluorination of Quinolines. J. Am. Chem. Soc.2023, https://doi.org/10.1021/jacs.3c07119
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn






