

(图片来源:Nature)
正文
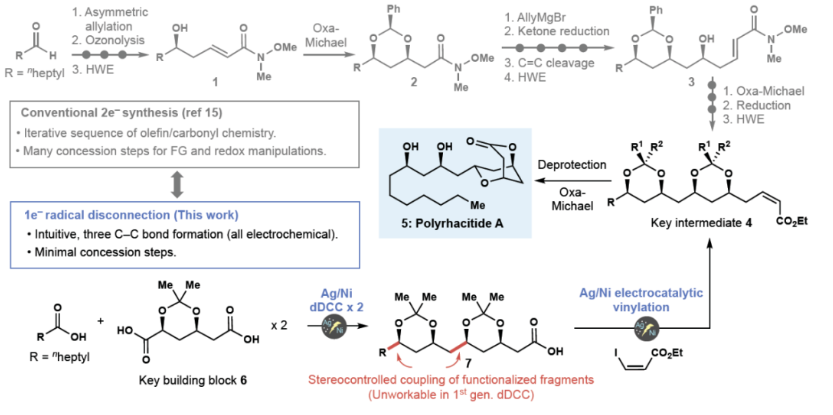
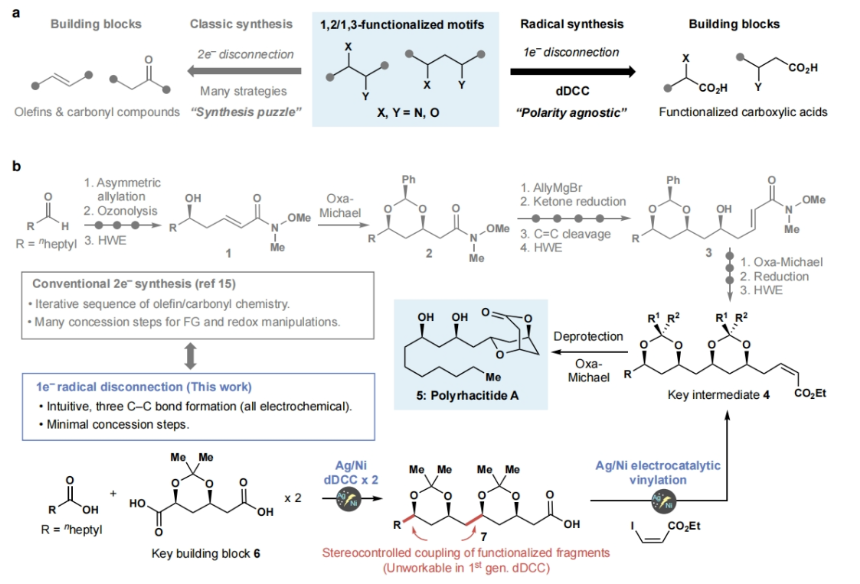
在现代合成化学中,逆合成分析通常是基于官能团之间的极性关系原理来指导合成路线的设计。这种方法被称为极性逆合成分析,通常将部分正电荷(亲电)或负电荷(亲核)分配给复杂分子中的不同组分,并断开相反电荷之间的化学键。虽然这种方法已被广泛使用,但它们的实施通常需要采取一系列措施(如保护基团的使用),以确保反应得以精确的进行。最近,美国斯克里普斯研究所Phil S. Baran和Yu Kawamata课题组发展了一种基于自由基的Ni/Ag电催化α-取代羧酸的交叉偶联反应,从而能够以一种直观和模块化的方法来实现复杂分子的构建(Figure 1)。
(图片来源:Nature)
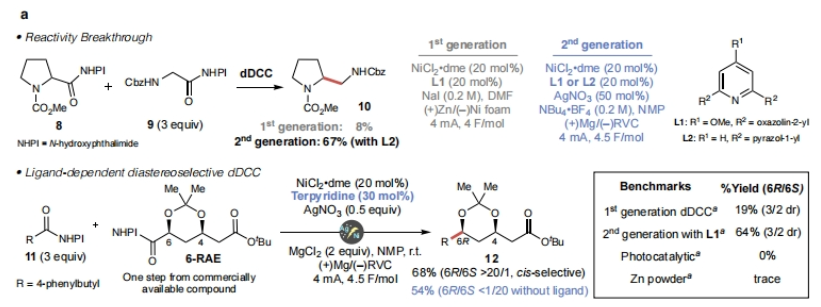
为了实现此设想,作者必须克服两个障碍:1)从反应性上来说,有必要扩大初始dDCC(doubly decarboxylative cross coupling)的范围,以兼容含有α-杂原子官能团化的底物;2)从立体选择性上来说,需要实现高非对映选择性的偶联过程。
首先,作者选用脯氨酸衍生物8和甘氨酸衍生物9作为模板底物进行反应探索。当使用第一代dDCC反应条件时,仅以8%的产率得到相应的偶联产物10,且观察到了脱酸产物。随后,作者变换反应溶剂为NMP、改变阳极材料为镁,且加入银盐(AgNO3)后即可以67%的产率得到产物10。至此得出第二代dDCC反应条件为:8 (0.1mmol, 1 equiv.), 9 (0.3 mmol, 3 equiv.), NiCl2•dme (0.02 mmol, 0.2 equiv.), L1 (0.02 mol, 0.2 equiv.) 或L2 (0.02 mmol, 0.2 equiv.), AgNO3 (0.05 mmol, 0.5 equiv.), TBABF4 (0.6 mmol, 6 equiv.), NMP (3.0 mL),(+)Mg/(-)RVC,4 mA,4.5 F/mol(Figure 2a)。
随后,作者进一步探此了此转化的非对映选择性问题。当在体系中加入三联吡啶(30 mol%)作配体以及MgCl2 (2 equiv.)作为路易斯酸添加剂时,可以以> 20:1 dr得到 (6R)-12(68%)。相反,当不使用配体时则可以以> 20:1 dr得到 (6S)-12(54%)(Figure 2a)。
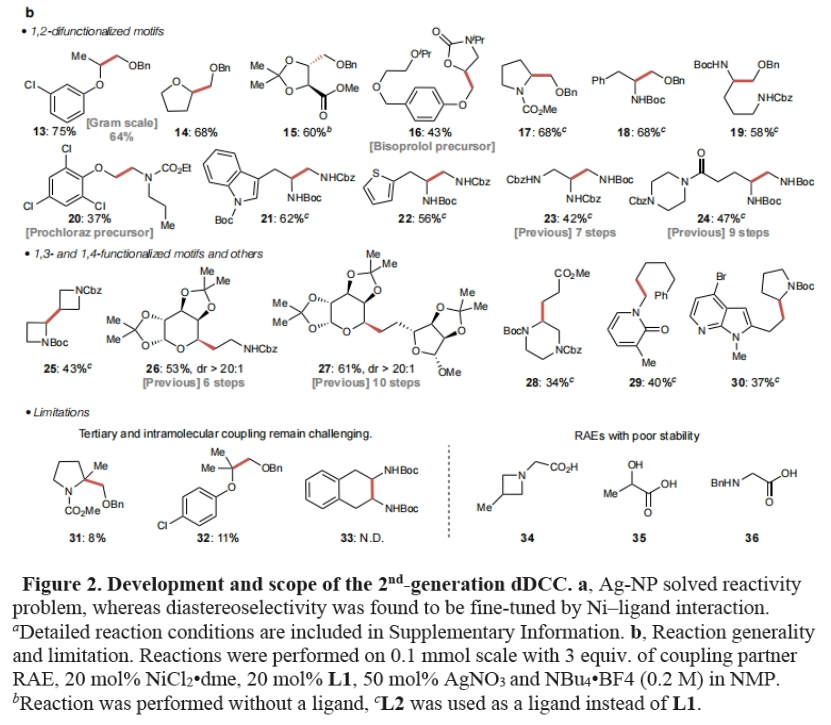
在解决了此转化的反应性和立体选择性问题之后,作者考察了此反应的底物适用性(Figure 2b)。实验结果表明,多种不同α-杂原子取代酸之间可以顺利发生的dDCC,以34-75%的产率得到相应的1,2-二醇(13-16)、氨基醇(17-20)、二胺(21-24)和酒石酸、氨基酸和糖等复杂分子衍生物(25-30)。值得注意的是,此转化可以实现克级规模合成(13, 64%),证明了此反应的实用性。
(图片来源:Nature)
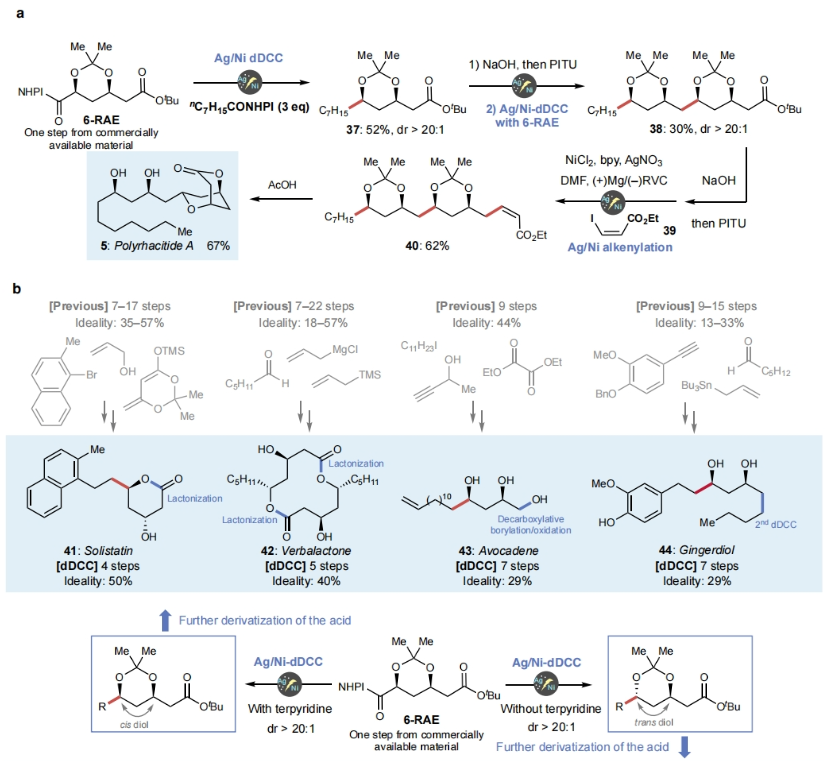
接下来, 作者利用发展出的策略实现了polyrhacitides A (5)的全合成(Figure 3a)。利用简单易得的起始原料6-RAE,通过与辛酸RAE的顺式选择性dDCC,可以以52%的分离产率,> 20:1 dr得到37。随后,37经历水解形成RAE后,该片段与另一个6-RAE片段结合,以30%的分离收率得到保护的多元醇酯38。接下来,38通过与烯基碘39经历脱羧烯基化以62%的产率得到40。最后,40在HOAc存在下以67%的产率得到产物5。
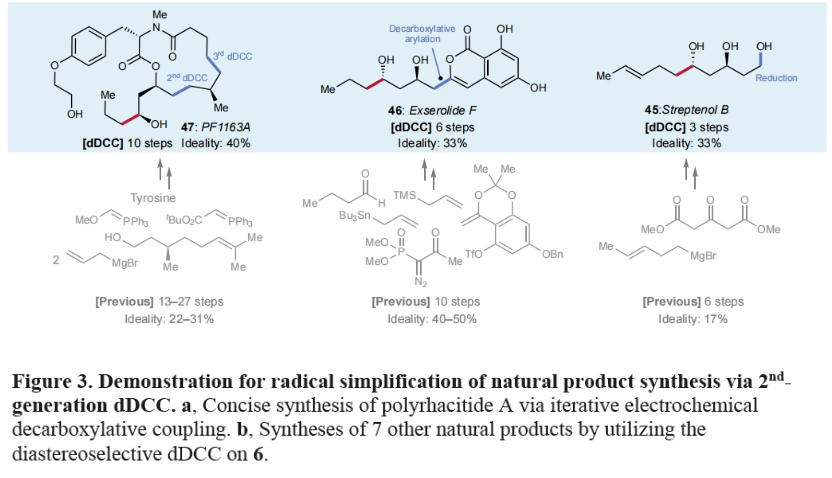
此外,实现5合成的策略还可以用于其它天然产物的全合成中,包括solistatine (41) (4步,50%), verbalactone (42)(5步,40%), avocadene (43)(7步,29%), gingerdiol (44)(7步,29%), streptenol B (45) (3步,33%), exserolide (46) (6步,33%)和PF1163A (47)(10步,40%),从而有效减少了合成步数,提高了总体产率。值得注意的是,所有这些天然产物的已报道合成途径均依赖于极性键的断开(Figure 3b)。
(图片来源:Nature)
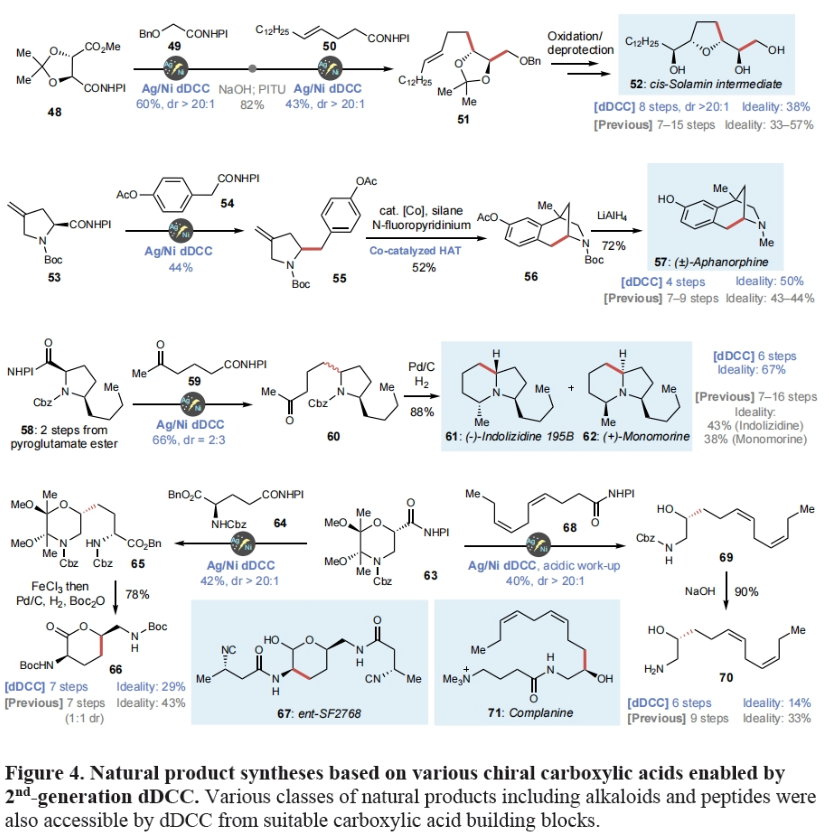
最后,作者利用发展的方法实现了另外六种天然产物的合成,进一步证明了此dDCC策略的高效性和实用性。如Figure 4所示,作者分别利用简单易得的48和53作为起始原料,仅分别通过8步(38%)和4步(50%)即可实现cis-Solamin中间体52和Aphanorphine 57的合成,且与已报道的合成方法相比在合成效率上均具有较大的优势。此外,作者使用焦谷氨酸盐衍生物58仅通过6步,以67%的产率同时实现了(-)-Indolizidine 195B (61)和 (+)-Monomorine I (62)的合成。值得注意的是,作者利用了吗啡啉取代的羧酸衍生物63分别通过7步(29%)和6步(14%)构建了66和70,从而实现了SF2768 (67)和complanine (71)的形式合成。更重要的是,从药物化学的角度来看,作者所发展的模块化合成方法为利用现有的羧酸实现一系列手性1,2-氨基醇骨架提供了便利。
(图片来源:Nature)
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn