

(图片来源:Nat. Commun.)
正文
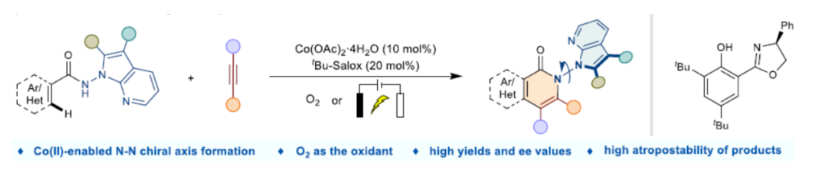
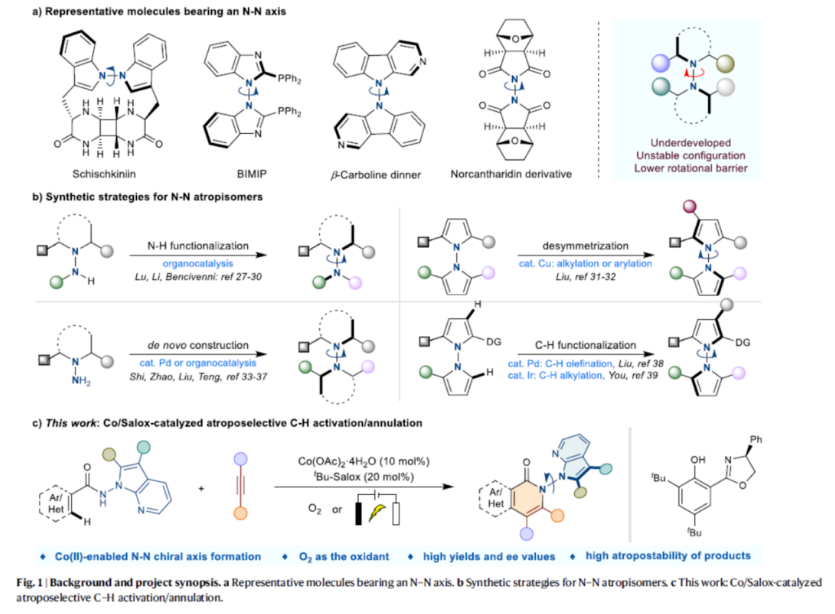
阻转异构体是一类有趣的轴手性化合物,在药物开发以及功能材料开发中备受关注。在过去的二十年中,化学家们已开发多种构建C-C和C-N阻转异构体的方法,包括轴手性联芳基、芳基胺和芳基酰胺等。虽然N-N轴骨架广泛存在于各类天然产物、生物活性分子、功能材料和配体中(Fig. 1a),但对于N-N轴手性骨架构建目前却较少有相关的研究报道(Fig. 1b)。目前,N-N轴手性骨架构建主要涉及四类反应,即阻转选择性N-H官能团化、去对称化、从头合成和C-H官能团化反应。然而,对于N-N轴手性骨架构建的高效且简便的合成方法,仍有待进一步探索。近日,郑州大学牛俊龙与杨丹丹团队报道了一种钴/Solox催化阻转选择性C-H活化/环化反应,高效构建了一系列N-N轴手性骨架,具有良好的官能团兼容性、温和的反应条件、优异的收率以及对映选择性等特点(Fig. 1c)。下载化学加APP到你手机,更加方便,更多收获。
(图片来源:Nat. Commun.)
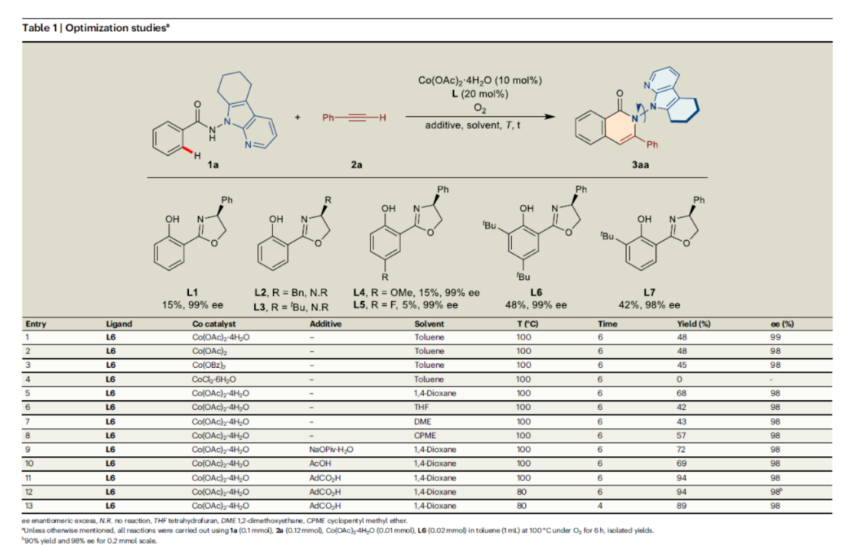
首先,作者以N-(7-氮杂吲哚)苯甲酰胺1a与苯乙炔2a作为模型底物,进行了相关反应条件的筛选(Table 1)。当以Co(OAc)2·4H2O(10 mol %)作为催化剂,L6(20 mol %)作为配体,O2作为氧化剂,AdCO2H(1.0 equiv)作为添加剂,在1,4-二氧六环溶剂中80 oC反应6 h,可以94%的收率得到产物3aa,ee为98%。
(图片来源:Nat. Commun.)
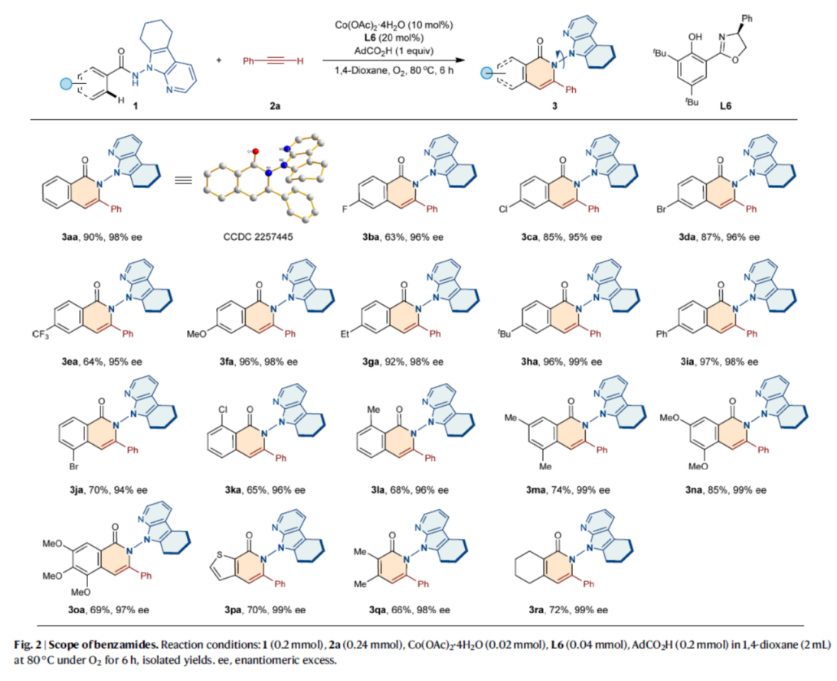
在获得上述最佳反应条件后,作者对苯甲酰胺类的底物范围进行了扩展(Fig. 2)。首先,苯甲酰胺底物的芳基上含有不同电子性质的取代基时,均可顺利反应,获得相应的产物3aa-3oa,收率为63-97%,ee为94-99%。值得注意的是,含有噻吩基取代的杂环底物1p,也是合适的底物,可以70%的收率和99% ee得到产物3pa。其次,具有挑战性的乙烯酰胺1q和1r,也能够顺利进行反应,获得相应的产物3qa-3ra,收率为66-72%,ee为98-99%。
(图片来源:Nat. Commun.)
紧接着,作者对炔烃的底物范围进行了扩展(Fig. 3)。首先,乙炔的末端含有芳基、杂芳基、环烷基、硅基、烷基、烷氧羰基等时,均可顺利反应,获得相应的产物3ab-3am,收率为45-95%,ee为95-99%。值得注意的是,该策略还可用于天然产物的后期修饰,获得相应的产物3an-3ao,收率为81-86%,de为97-98%。其次,对于对称的脂肪族内炔烃,也能够顺利反应,获得相应的产物3ap-3as,收率为73-90%,ee为97-99%。此外,对于非对称内炔烃底物,可以50%的收率和98% ee得到产物3at。
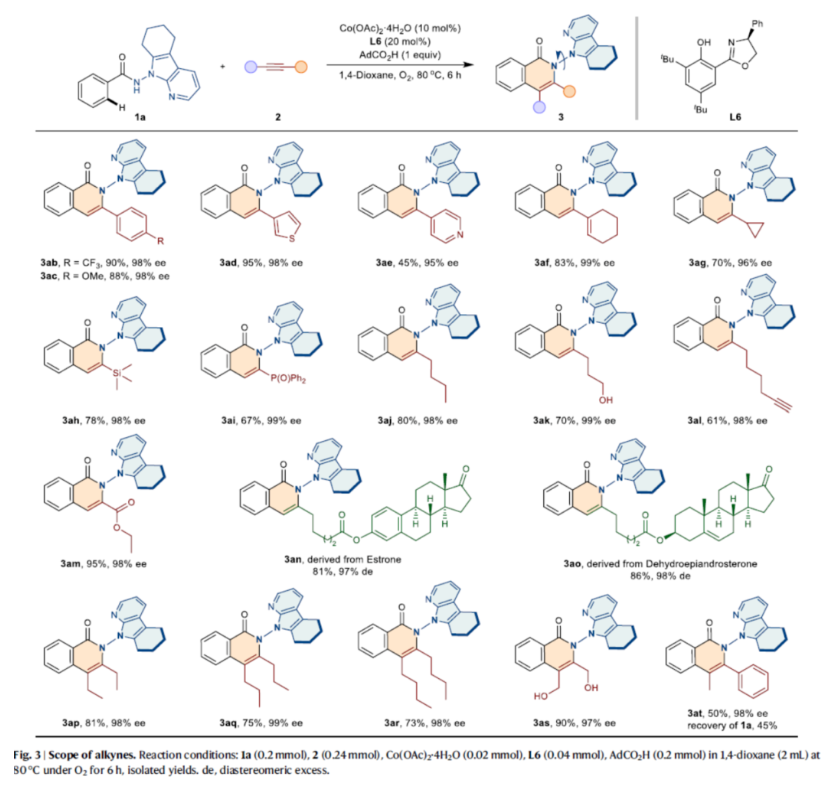
(图片来源:Nat. Commun.)
随后,作者对底物1中7-氮杂吲哚环上取代基的范围进行了扩展(Fig. 4)。研究表明,含有环己烷、2-乙基、2-甲基取代的氮杂吲哚底物,均可顺利反应,获得相应的产物3sa-3ua,收率为78-85%,ee为97-98%。同时,在氮杂吲哚环C2-和C3-位含有不同官能团的苯甲酰胺,也能够顺利进行反应,获得相应的产物3va-3xa,收率为70-81%,ee为97-98%。
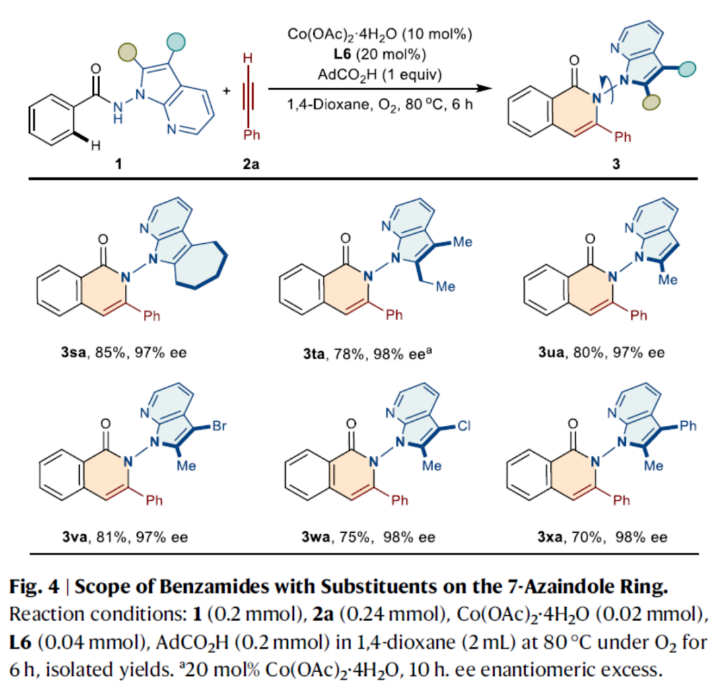
(图片来源:Nat. Commun.)
为了进一步提高反应的实用性,作者进行了相关的电化学实验(Fig. 5)。研究结果表明,在该电化学条件下,同样可获得所需的产物3aa、3ia、3ah和3aq,收率为63-69%,ee为97-98%。
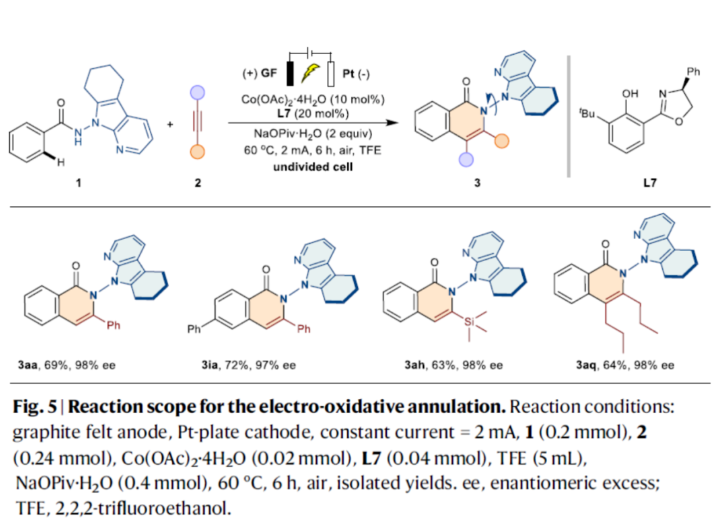
(图片来源:Nat. Commun.)
此外,作者还对产物的稳定性进行了研究(Fig. 6)。研究结果表明,N-N轴手性异喹啉酮具有高度的阻转稳定性。
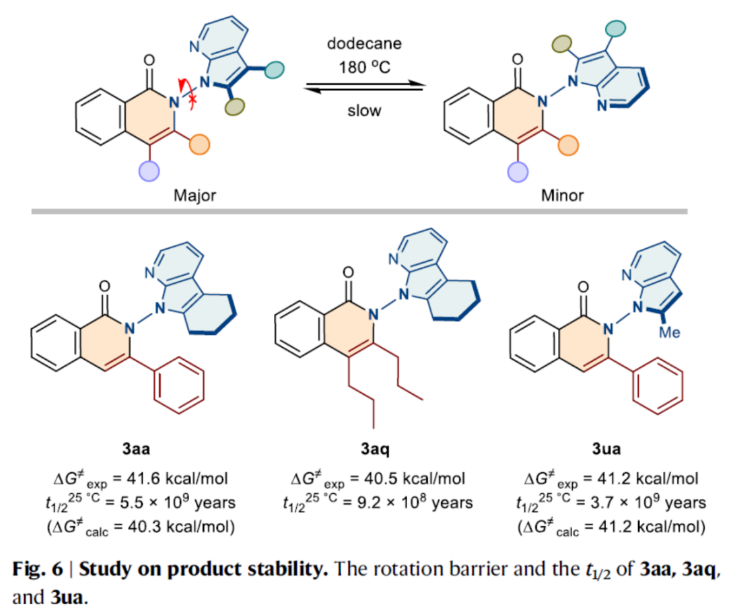
(图片来源:Nat. Commun.)
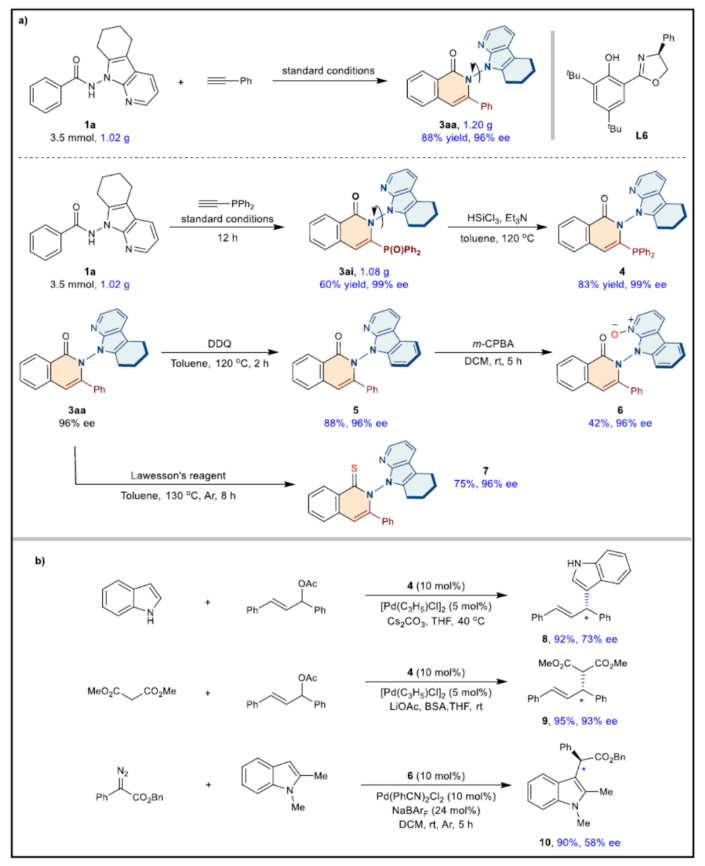
随后,作者对反应的实用性进行了研究(Fig. 7)。首先,克级规模实验,同样能够以88%收率和96%ee得到产物3aa以及以60%收率和99%ee得到产物3ai。其次,3ai经还原反应,可以83%收率和99%ee得到单膦产物4。3aa经氧化反应,可以88%收率和96%ee得到化合物5。化合物5在m-CPBA条件下进行反应,可以42%收率和96%ee得到N-氧化物6。3aa与Lawesson’s试剂反应,可以75%收率和96%ee得到硫代化合物7。此外,合成的产物4和6可作为合适的手性配体,并可用于不对称钯催化的吲哚烯丙基取代反应、Tsuji-Trost反应等,获得相应的化合物8-10,收率为90-95%,ee为58-93%。

(图片来源:Nat. Commun.)
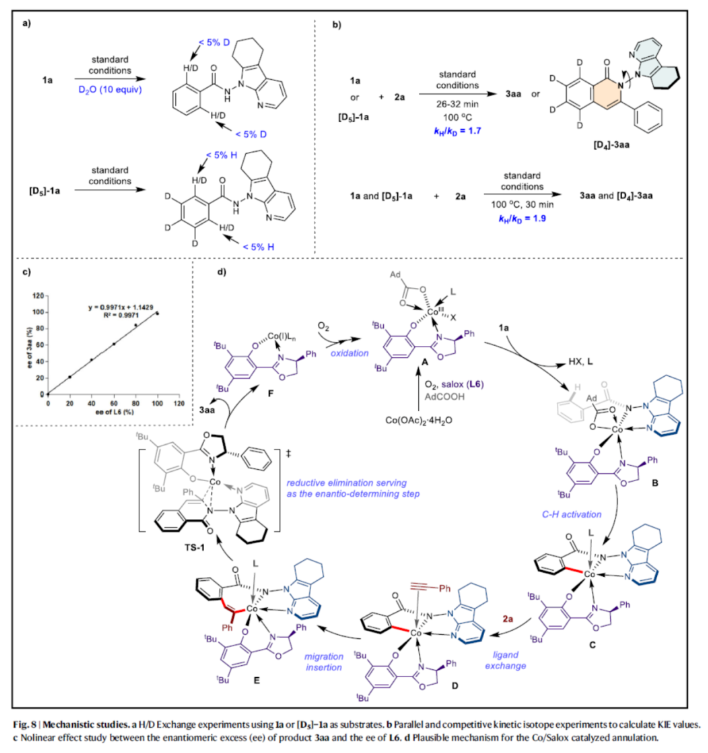
最后,作者还对反应机理进行了进一步的研究(Fig. 8)。H/D交换实验结果表明,C-H键的断裂是不可逆的(Fig. 8a)。KIE实验结果表明,C-H键的断裂可能参与了决速步骤(Fig. 8b)。产物3aa的ee和L6的ee之间的非线性效应研究表明,单个手性配体与钴原子配位以生成有效的催化剂(Fig. 8c)。基于上述的研究以及相关文献的查阅,作者提出了一种合理的催化循环过程(Fig. 8d)。首先,Co(OAc)2·4H2O与L6和AdCO2H配位,并通过O2进行氧化,生成活性Co(III)-配合物A。配合物A与底物1a进行配体交换,生成Co(Ⅲ)-中间体B。中间体B通过C-H键的活化,生成关键的中间体C。值得一提的是,不能完全排除涉及第一个C-H活化步骤和随后的氧化步骤以形成中间体C的另一途径。随后,炔烃2a与中间体C配位,并通过配体交换生成中间体D。中间体D中的炔基迁移插入到C-Co键中,生成中间体E。中间体E通过还原消除,生成N-N轴手性产物3aa以及Co(I)中间体F。值得注意的是,该过程通过过渡态TS-1的还原消除进行,由于L6的苯基与1a的7-氮杂吲哚导向基团之间的π-π堆积相互作用,其具有最低的能量,可以作为对映体的决定步骤。
(图片来源:Nat. Commun.)
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn