

帕金森症(Parkinson’s disease)是一种常见的神经退行性疾病,其典型病理特征为脑黑质致密部病变和多巴胺浓度显著降低。帕金森症会引起运动障碍/迟缓、静息性震颤、认知障碍等症状。帕金森症无法治愈,严重危害患者生命。而该疾病的早期、准确诊断和合理的治疗是减缓病情发展和延长患者生命的重要途径。目前,帕金森症的诊断方法包括影像学、脑脊液分析、基因检查等,存在滞后、间接、主观性强、受其它脑部疾病干扰等缺点,容易造成误诊、漏诊和延迟诊断。帕金森症治疗方式主要为口服左旋多巴(Levodopa, L-Dopa)。左旋多巴能够在脑组织内被单胺能神经元转化为多巴胺,从而达到治疗帕金森症的目的。但受个体差异、病程和耐药性影响,左旋多巴药物剂量较难准确控制,治疗过程易引起严重副反应。针对上述问题,苏彬课题组将脑电化学测量和动态给药系统结合,发展了一种帕金森症闭环诊断和治疗方法,该方法不仅能够通过脑内多巴胺浓度水平诊断/跟踪帕金森症,还能够通过实时测量的浓度信息动态调节左旋多巴给药速度和剂量,有效提高左旋多巴治疗效果。该研究工作为帕金森症的诊断和治疗提供了新思路。相关成果最近发表在美国化学会志期刊上(J. Am. Chem. Soc., doi.org/10.1021/jacs.3c08256)。
作者首先将共价有机框架材(COF)薄膜修饰于碳纤维微电极表面(电极简称为cCFE,图1),利用COF薄膜亲水性、电荷选择性和纳米孔道空间限域作用提高脑内多巴胺测量准确性和稳定性(图2)。具体如下所述:(1)抗生物污染性能。生物污染,包括蛋白质非特异性吸附、细胞黏附和生物免疫反应,会污染电极表面,影响传荷/传质过程,大幅降低植入电极性能。COF薄膜能够通过纳米孔道尺寸选择性、表面亲水性和电荷选择性抑制电极表面蛋白质非特异性吸附、细胞黏附和生物免疫反应,大幅提高电极抗生物污染性能和脑内稳定性;(2)抗化学污染性能。多巴胺和其氧化产物容易在电极表面发生化学聚合,形成聚多巴胺,极大影响电极多巴胺检测性能。COF的纳米孔道可以通过纳米限域作用控制多巴胺分子构象,调控其氧化过程,避免氧化产物或聚多巴胺在电极表面形成和吸附,抑制电极表面化学污染;(3)多巴胺选择性。脑内存在多种与多巴胺结构、电荷和电化学性质相似的神经递质,主要包括血清素(Serotonin, 5-HT)、肾上腺素(Epinephrine, EP)和去甲肾上腺素(Norepinephrine, NE)。这些递质信号与多巴胺信号重合,会影响电化学测量结果准确性。作者利用不同种类神经递质与COF孔道间吸附能的差异,调控不同神经递质通过孔道到达电极表面的难易程度,从而实现cCFE对多巴胺的选择性测量。
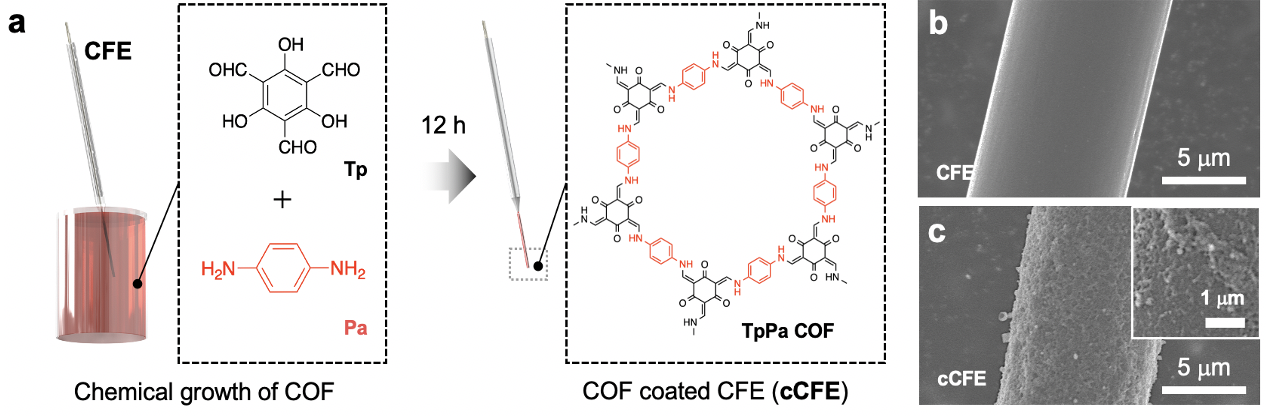
图1.(a)共价有机框架薄膜修饰碳纤维电极(cCFE)的制备;(b, c)碳纤维微电极(CFE)和cCFE的扫描电子显微镜图。
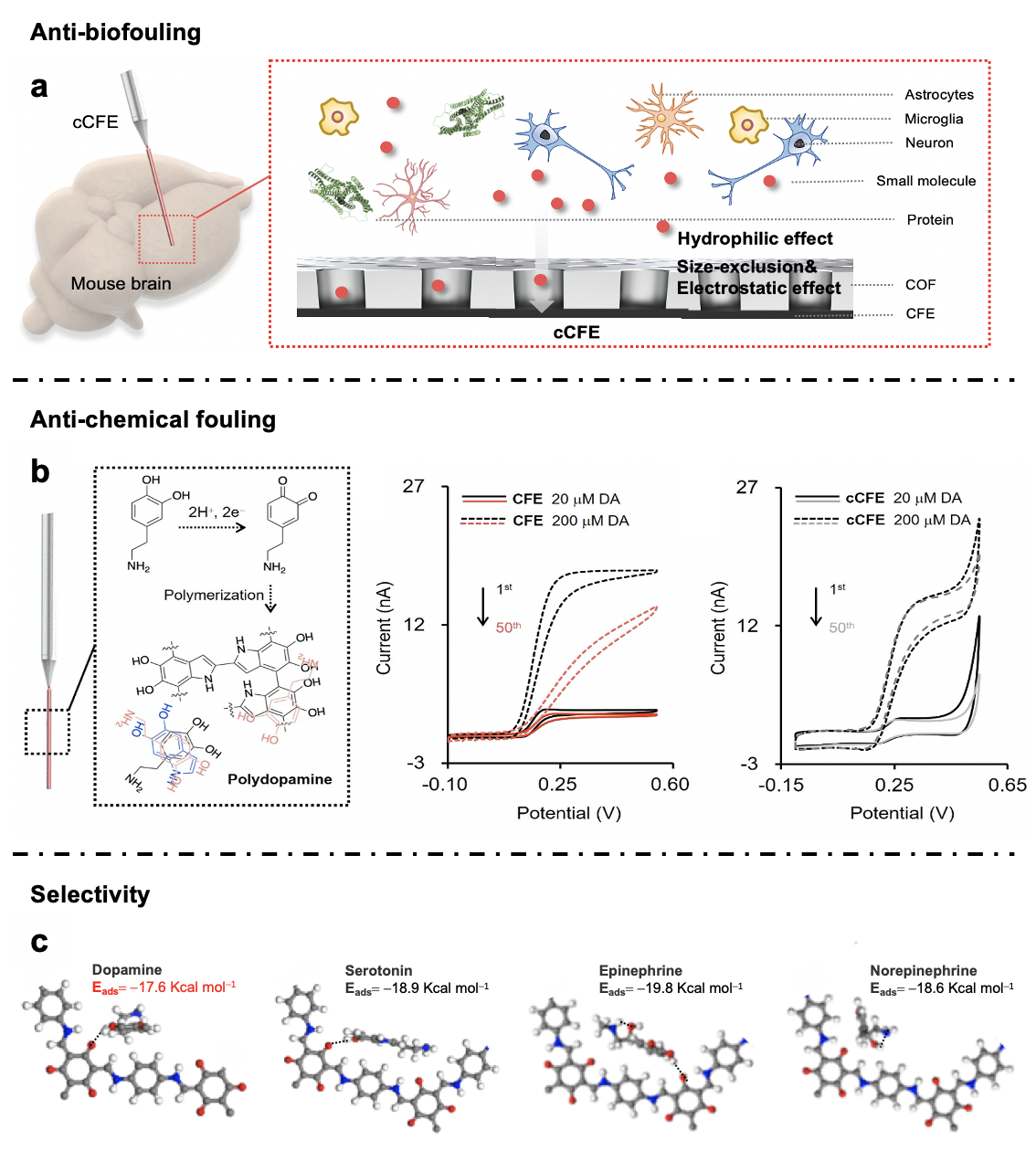
图2. cCFE的抗生物污染性能(a)、抗化学污染性能(b)和多巴胺选择性(c)。
最后,作者将脑电化学测量与动态给药系统结合,发展一种帕金森症闭环诊断和治疗方法(图3a)。由于多巴胺能神经元凋亡,帕金森病模型小鼠脑内缺少有效的多巴胺调节机制,在单次注射高剂量左旋多巴后帕金森模型鼠脑纹状体中多巴胺浓度大幅上升,远高于正常范围,进而引起心率异常等不良药物反应(图3b)。而该闭环系统能够利用实时测量的脑内多巴胺浓度信息动态调节左旋多巴给药速度和剂量,有效提高左旋多巴治疗效果、避免不良药物反应。在该闭环治疗模式下,帕金森病模型小鼠脑多巴胺浓度均位于正常水平范围(图3c)。此外,帕金森患者脑黑质致密部多巴胺能神经元大量凋亡会引起纹状体内多巴胺浓度显著降低。通过直接测量的状体内多巴胺浓度还可辅助帕金森症诊断。
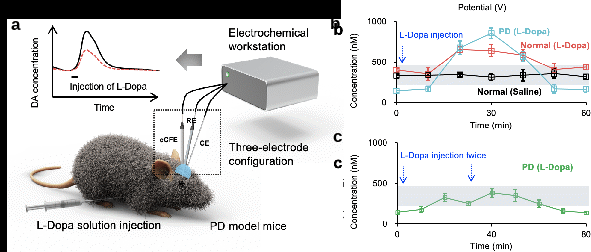
图3.(a)帕金森症闭环诊断和治疗方法示意图;(b)单次注射高剂量左旋多巴或生理盐水后健康鼠和帕金森模型小鼠纹状体中多巴胺浓度随时间变化;(c)采用闭环方法多次注射低剂量左旋多巴后帕金森模型小鼠纹状体中多巴胺浓度随时间变化。
小结:在本工作中,作者首先发展了一种兼具优良电化学性能、抗生物污染性能、抗化学污染性能和选择性的脑多巴胺测量电极,实现小鼠脑内多巴胺浓度的长时、连续、稳定和灵敏测量。然后,将脑电化学测量技术与动态给药结合,发展了一种帕金森症闭环治疗方法,并探究了新疗法在疗效和避免不良反应中的优势。该研究工作可为帕金森症的诊断和治疗提供指导。
浙江大学化学系博士后周璘和博士研究生杨蓉婕为本文的共同第一作者,通讯作者是浙江大学苏彬教授。该项目受到国家自然科学基金等经费资助。
文章链接:https://pubs.acs.org/doi/10.1021/jacs.3c08256?ref=PDF
苏彬教授课题组链接:https://person.zju.edu.cn/binsu
T细胞表位抗原疫苗与T细胞受体(TCR)-T细胞疗法是抗肿瘤领域两种新颖的免疫治疗策略,显示出极为优越的疗效。T细胞表位抗原疫苗是通过引入特定肿瘤抗原多肽,刺激患者体内自身T细胞产生高效肿瘤免疫应答;而TCR-T细胞疗法则利用基因工程技术使T细胞表达特定肿瘤特异性TCR克隆,高效识别肿瘤抗原并杀死肿瘤细胞。准确筛选并鉴定有效肿瘤特异性抗原多肽及TCR克隆是肿瘤治疗领域的一大难点。
近日,苏彬课题组通过免疫突触的电化学发光(ECL)成像,实现了T细胞肿瘤抗原识别的免标记分析(图1)。将特异性刺激分子修饰在基底电极表面,刺激并激活T细胞,使其形成免疫突触。由于细胞粘附抑制ECL反应,因此ECL图像中免疫突触形成区域表现为暗斑。通过分析细胞的铺展面积和识别强度来评估免疫突触的结合特性,实现了对不同种类肿瘤抗原(pMHC)、不同抗原反应性的TCR以及形成免疫突触所需的相关辅助分子(如信号传递分子CD3、共刺激分子CD28和粘附分子LFA1)的区分。这种免标记的成像策略有望应用于高效肿瘤特异性抗原多肽及TCR克隆的筛选与鉴定。相关成果最近发表在德国应用化学期刊上(Angew. Chem. Int. Ed. doi.org/10.1002/anie.202314588)。
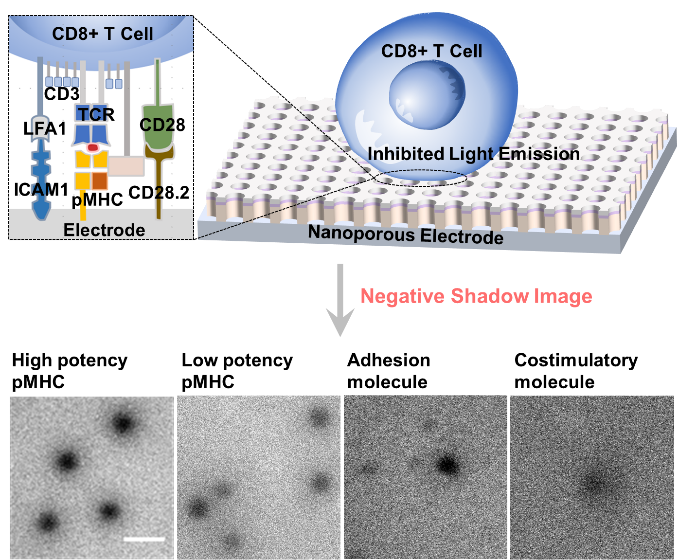
图1. T细胞抗原识别和区分的免标记ECL成像示意图
T细胞通过其表面的TCR识别肿瘤细胞上的特异性抗原,与肿瘤细胞形成稳定免疫突触,从而释放穿孔蛋白酶和细胞因子等,以达到杀伤肿瘤细胞的目的。鉴于免疫突触结构决定着T细胞对肿瘤细胞的杀伤,可将其作为T细胞肿瘤特异性抗原识别的特征。目前,通常运用荧光成像技术(如全内反射荧光成像)来表征免疫突触的形成。但其需要额外的荧光标记,且易受细胞自体荧光和荧光分子光漂白特性的限制。因此,迫切需要开发快速和免标记的成像方法来表征免疫突触的形成,用于鉴定有效的肿瘤特异性抗原多肽及TCR克隆。
课题组前期工作采用ECL成像技术实现了对细胞黏着和细胞间连接的顺次成像。在此基础上,该工作通过改变ECL分子与共反应剂的浓度比来调控ECL反应路径,以获得限域或延展的发光层(分别对应氧化还原路径和催化路径),并将其应用于T细胞免疫突触成像。实验结果表明氧化还原路径主导的电化学发光更适合成像免疫突触(图2)。这是因为免疫突触是在T细胞基底膜与电极表面接触的微区内形成,表面限域的发光层才能有效地对免疫突触这一界面结构进行良好观察。

图2. 调控发光层厚度,成像T细胞免疫突触
随后采用上述表面限域ECL成像体系对多种肿瘤抗原多肽及不同克隆TCR-T细胞进行配对识别验证。结果显示,ECL可对TCR-T细胞与对应的特异性肿瘤抗原形成稳定的免疫突触结构进行成像;通过对ECL图像进行分析,定量评估免疫突触形成的面积和强度,实现了T细胞抗原识别强弱的区分(图3)。

图3. 对多种肿瘤抗原多肽及不同克隆TCR-T细胞进行配对识别验证
综上所述,该工作开发了一种T细胞免疫突触的免标记ECL成像技术,并将其用于肿瘤特异性抗原多肽及TCR克隆的鉴定。该技术有望用于肿瘤特异性抗原及TCR克隆的筛选,这对T细胞表位抗原疫苗与TCR-T细胞疗法的发展至关重要。
本文的作者是浙江大学化学系博士研究生颜亚娟(化学系21级直博生)、浙江大学生物系统工程与食品科学学院博士后周萍和浙江大学化学系博士研究生丁鹭榕(化学系23级硕博连读生)。通讯作者是浙江大学化学系苏彬教授、基础医学院陈伟教授和医学院附属第一医院胡炜特聘研究员。该项目受到国家自然科学基金的经费资助。
文章链接:https://doi.org/10.1002/anie.202314588
课题组链接:https://mypage.zju.edu.cn/binsu/696525.html
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn