

(图片来源:J. Am. Chem. Soc.)
正文
吲哚是天然产物和小分子药物中最广泛存在的杂环骨架之一。虽然化学家们已经发展出一系列涉及极性、自由基或有机金属活性的合成方法来构建吲哚,但发展高官能团兼容性的反应体系,利用简单易得的起始原料,来实现一系列不同取代吲哚的合成仍然迫切需要。下载化学加APP到你手机,更加方便,更多收获。
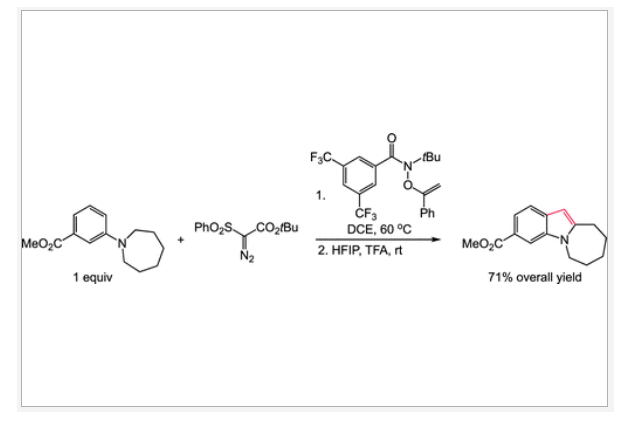
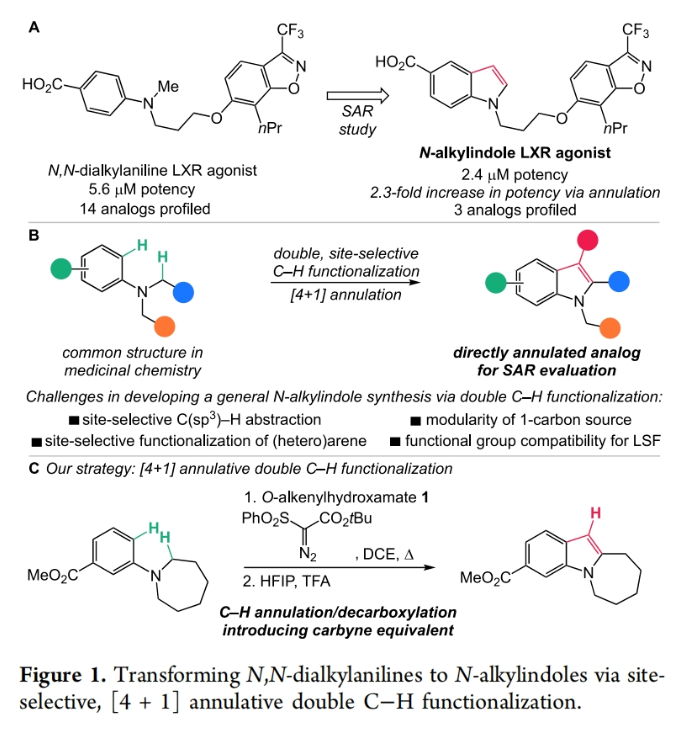
利用结构多样的N,N-二烷基苯胺(来源于丰富的(杂)芳基卤化物和仲胺)转化为N-烷基吲哚可以有效促进药物化学研究中的构效关系(SAR, structure-activity relationship)探索(Figure 1a)。其中,通过双C-H官能团化来实现单原子[4 + 1]环化是最重要的方法之一(Figure 1b)。然而,对底物氧化的要求极大地限制了此策略的应用范围,从而导致非对称底物的不良区域控制以及有限的官能团兼容性,因此不适合应用于分子的后期修饰应用。其中,两个C-H官能团化的区域控制是一个主要的挑战,因此N-烷基的氢原子转移(HAT)和(杂)芳环的均裂芳基取代(HAS)都必须加以控制。此外,目前还没有在单原子环化过程中引入碳炔(carbyne)等价物的先例,从而获得实现C3-未取代吲哚的合成。最近,美国北卡罗来纳大学教堂山分校Erik J. Alexanian课题组报道了一种利用简单易得的N,N-二烷基苯胺的双位点选择性C(sp3)-H/C(sp2)-H[4+1]环化来实现N-烷基吲哚的合成(Figure 1c)。
(图片来源:J. Am. Chem. Soc.)
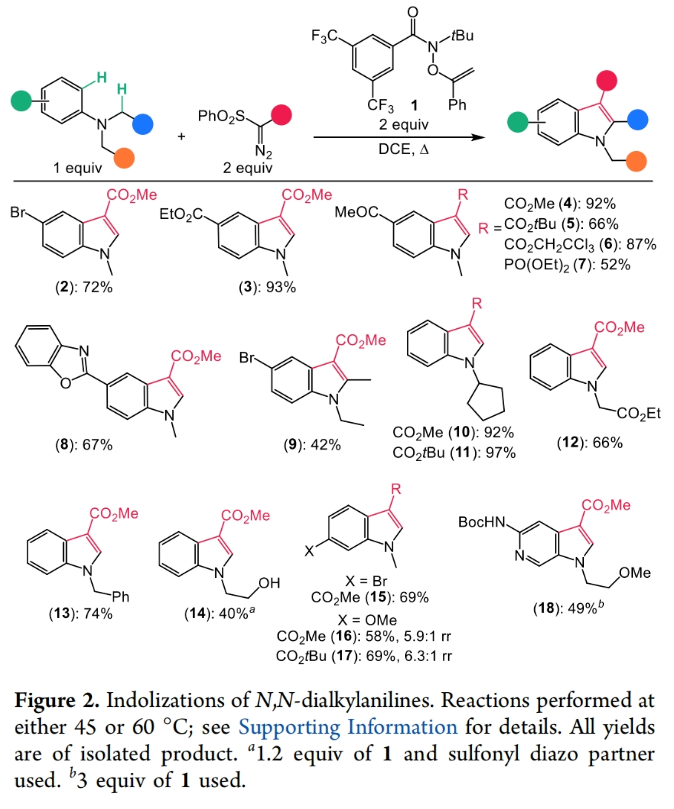
首先,作者使用N,N-二烷基苯胺(1.0 equiv)、O-alkenylhydroxamate 1(2.0 equiv)和磺酰基重氮化物(2.0 equiv)为起始原料,仅在DCE中加热即可以40-97%的产率得到相应的N-烷基吲哚产物2-18。值得注意的是,此转化具有良好的官能团兼容性,包括卤素、游离羟基、烷基、酯基等一系列官能团均可良好兼容(Figure 2)。
(图片来源:J. Am. Chem. Soc.)
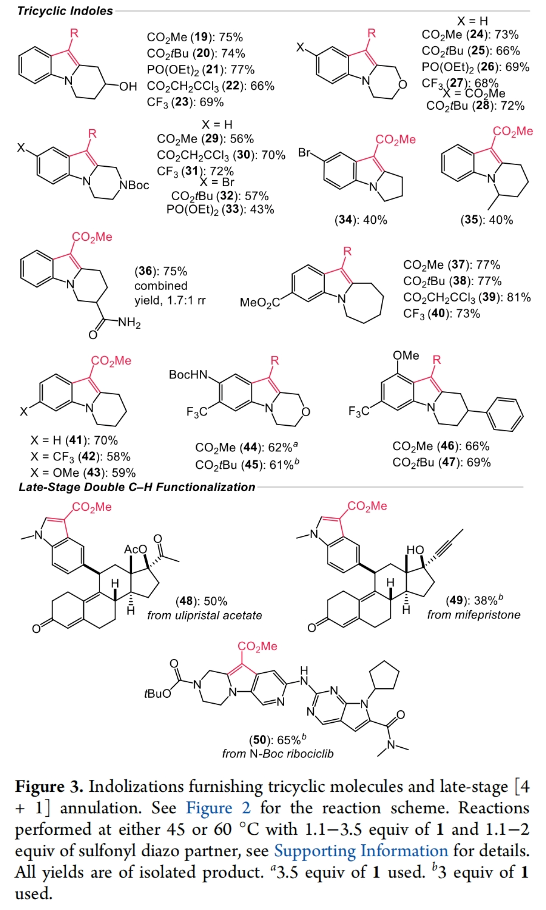
随后,作者将所发展的双C-H官能团化反应应用于多种在天然产物和药物中常见骨架—[1,2]环化吲哚的合成(Figure 3)。涉及哌啶(19-23)、吗啡啉(24-28)和哌嗪(29-33)等杂环的底物,可以与包括((1-重氮-2,2,2-三氟乙基)磺酰基)苯在内的一系列磺酰基重氮化物反应,以43-77%的产率实现包括3-三氟甲基吲哚在内的一系列[1,2]环化吲哚19-47的合成。值得注意的是,对于一系列复杂生物活性分子药物ulipristal acetate、mifepristone以及N-Boc ribociclib等均可顺利兼容此转化,以38-65%的产率得到相应的吲哚衍生物48-50。
(图片来源:J. Am. Chem. Soc.)
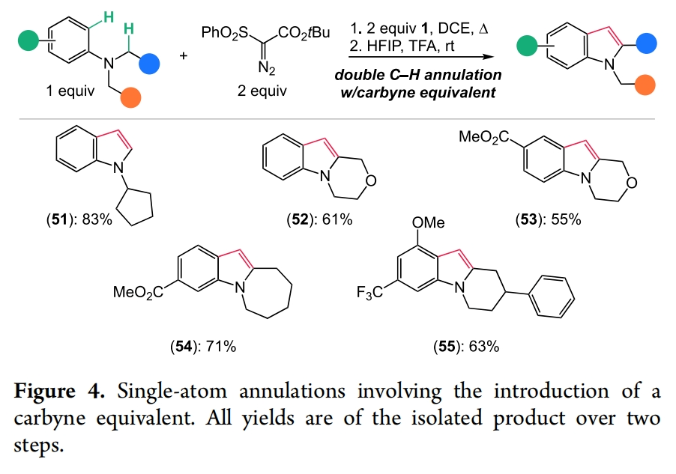
为了进一步提高此[4 + 1]环化过程的通用性,作者通在吲哚化过程中引入的可脱除的酯基(叔丁酯),并通过后续的原位脱除策略(HFIP,TFA,rt),一锅两步以55-83%的产率实现了一系列C3-未取代吲哚51-55的合成(Figure 4)。
(图片来源:J. Am. Chem. Soc.)
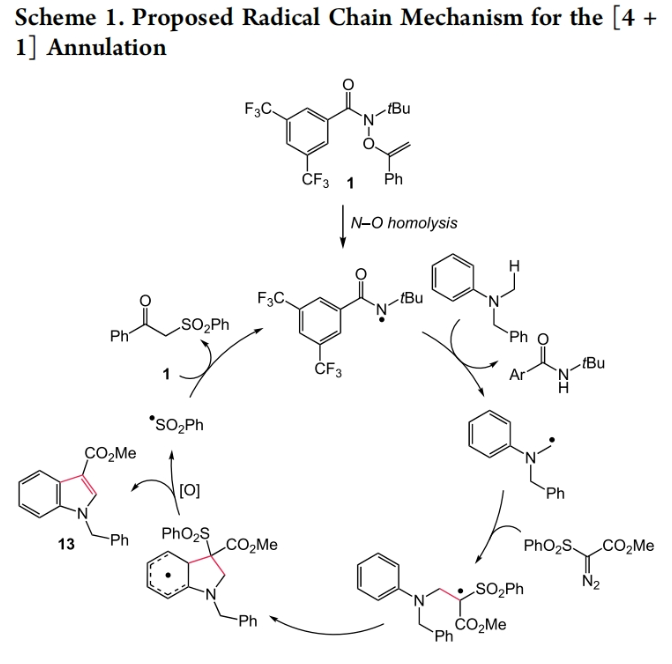
最后,作者提出了此转化可能的反应机理(Scheme 1):首先,大位阻的叔丁基酰胺氮自由基经历位点选择性的HAT后,通过与重氮化物的碳自由基加成并失去一分子氮气得到缺电子碳中心自由基中间体。随后其与分子内的芳环经历高区域选择性的加成,并通过氧化芳构化得到产物13并得到苯磺酰基自由基。尽管作者也曾考虑通过卡宾中间体的反应途径,但计算结果表明卡宾中间体途径会涉及到较高的能量。
(图片来源:J. Am. Chem. Soc.)
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn