

(图片来源:J. Am. Chem. Soc.)
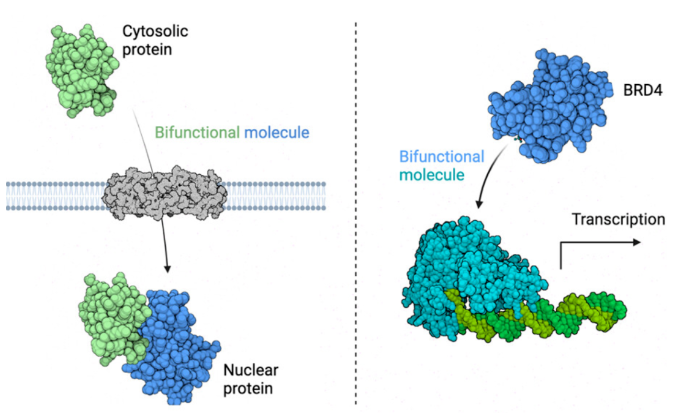
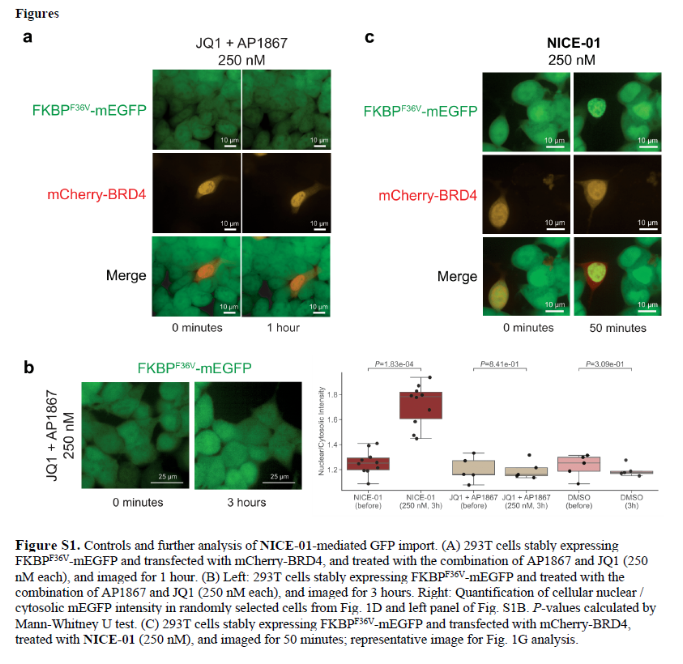
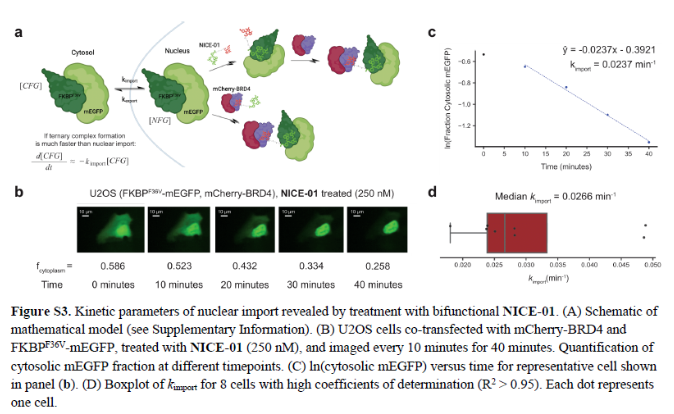
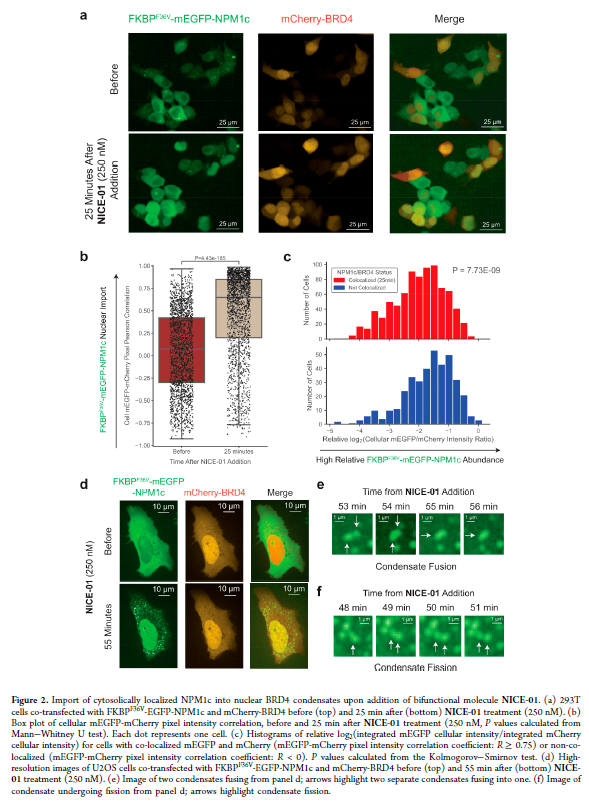
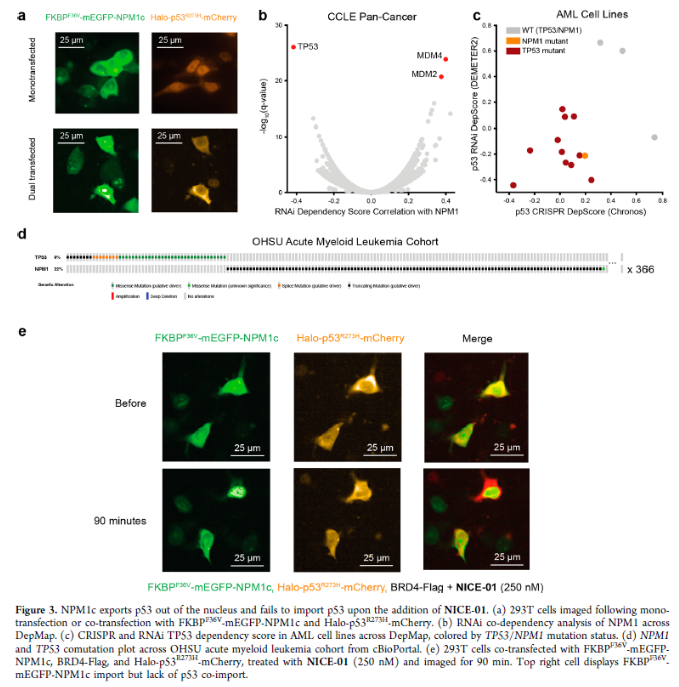
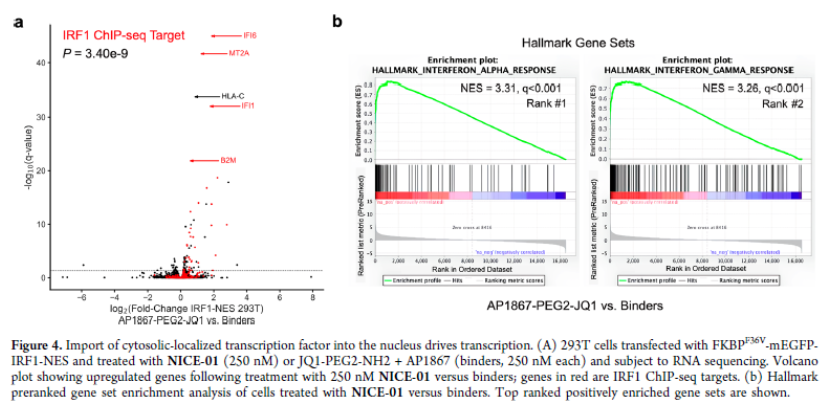
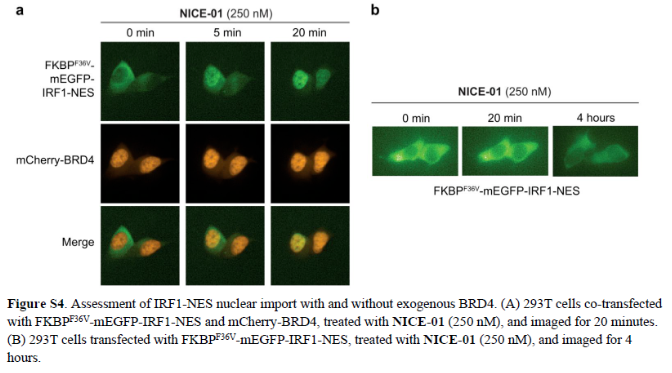
正文 细胞被划分为不同的隔间,以调节信息流并聚集生物分子。在真核细胞中,有两个主要的区室:细胞质和细胞核。最近的研究进一步强调了蛋白质空间定位的重要性,蛋白质在细胞中的异常定位是各种疾病发展的关键因素。为了更好地理解并潜在地操纵蛋白质定位以治疗各种相关疾病,作者设计了一种双功能分子来达到上述目的。下载化学加APP到你手机,更加方便,更多收获。 首先,作者假设化学诱导靶蛋白与组成性核蛋白的接近将实现靶蛋白核定位(图1a)。为了证实这一点,作者选取了一种丰富的、核定位的且具有经过充分验证的、可以功能化的小分子结合剂的蛋白质——BET溴结构域蛋白,并以JQ1为其配体,合成了由JQ1和AP1867组成的双功能分子(NICE-01,图1b),AP1867用来结合FKBPF36V。随后作者发现,在FKBPF36V-mEGFP和mCherry-BRD4共转染的细胞中添加NICE-01(200 nM,40分钟;图1c)后FKBPF36V-EGFP快速易位到细胞核。然后,作者假设内源性含BET的蛋白质可以用作核导入的“载体”。在稳定表达FKBPF36V-mEGFP的细胞中,NICE-01(250 nM,3小时)可以在细胞核中富集mEGFP(图1d和图S1)。 双功能化合物的一个决定性特征是观察到“钩效应”(hook effect)。在缺乏外源mCherry-BRD4的细胞中,10 μM NICE-01不能诱导FKBPF36V-mEGFP的入核。然而,在该剂量下转染mCherry-BRD4能够让入核发生(图1f)。这与理论一致,即在给定浓度的化合物下,三元复合物形成的减少可以通过进一步添加蛋白质来缓解。 (图片来源:J. Am. Chem. Soc.) 随后,作者还发现,三元复合物组分的化学计量是影响核导入的关键。当依赖于内源性BET蛋白时,FKBPF36V-mEGFP的入核程度较弱,缺乏mEGFP胞质排斥(图1g和图S1),这可能与通过瞬时转染获得的蛋白水平异常高于内源性蛋白水平有关。这一结果表明,核导入的细胞特异性一部分表现在核定位载体表达的数量差异。另外,配体亲和力似乎也很重要。 (图片来源:J. Am. Chem. Soc.) 接下来,作者假设可以使用化合物处理后观察到的FKBPF36V-mEGFP浓度的变化来计算蛋白质在核膜中扩散的动力学参数并构建了一个核导入步骤的模型(图S3)。对单个细胞的胞质FKBPF36V-mEGFP的部分进行定量。在短的初始期后,核输入相对于细胞质中的FKBPF36V-mEGFP部分显示出一级动力学(图S3)。这个估算的结果接近HeLa细胞中麦芽糖结合蛋白的被动输入速率。这些数据表明,结合BRD4的双功能化合物诱导靶蛋白封闭在核内。 (图片来源:J. Am. Chem. Soc.) 先前的研究表明,将细胞质突变体NPM1c重新定位到细胞核中可以减少HOX基因的表达,从而诱导白血病分化和细胞死亡。用FKBPF36V-mEGFP-NPM1c和mCherry-BRD4共转染的细胞在用NICE-01处理后几分钟内显示FKBPF36V-mEGFP-NPM1c快速重新定位到细胞核中(图2a)。 (图片来源:J. Am. Chem. Soc.) 有趣的是,并不是所有的细胞对化合物处理都表现出一致的反应。作者分析了导入程度不同的细胞的FKBPF36V-EGFP-NPM1c与mCherry-BRD4的比率(图2c)。数据表明,三元复合物组分的化学计量可以影响对双功能化合物的表型反应,并可以解释观察到的单细胞表型异质性。 作者用双功能化合物处理NPM1c和BRD4共转染的U2OS细胞,然后每1分钟进行一次高分辨率显微镜成像,证实了胞质和核仁凝聚物中的NPM1c移动到BRD4凝聚物中(图2d)。作者还注意到FKBPF36V-mEGFP掺入核凝聚物中,即使它们依赖于内源性含BET的蛋白质入核(图1e)。这些发现表明,邻近诱导分子可以针对性地改变凝聚物的组成。 随后,作者假设p53能够作为核载体来诱导NPM1c在细胞核中的定位。用FKBPF36V-mEGFP-NPM1c和Halo-p53R273H-mCherry转染293T细胞,令人惊讶的是, Halo-p53R273H-mCherri仅在与FKBPF36V-mEGFP-NPM1c共转染时定位于细胞质(图3a)。 (图片来源:J. Am. Chem. Soc.) 细胞溶质p53与DNA在物理上分离,其大部分肿瘤抑制活性可能受到抑制。因此,NPM1c介导的p53出核可能对突变的致癌性至关重要,这一点尚不清楚。作者发现NICE-01并不能在表达BRD4 Flag和FKBPF36V-mEGFP-NPM1c的293T细胞中重新定位Halo-p53R273H-mCherry,这表明p53并不总是以一定的共定位方式与NPM1c在物理上连接(图3e)。 (图片来源:J. Am. Chem. Soc.) 最后,作者认为NICE-01可以诱导转录因子IRF1的核导入和转录激活。在不存在双功能化合物的情况下,FKBPF36V-mEGFP-IRF1-NES从细胞核中移出(图S4)。当用NICE-01(250 nM)处理时,在共表达mCherry-BRD4和FKBPF36V-mEGFP-IRF1-NES的细胞中可以观察到mEGFP快速导入(<20分钟)。然而,在没有外源性BRD4的情况下,作者无法通过光学显微镜检测到FKBPF36V-mEGFP-IRF1-NES的输入,这可能是因为与BRD4相比,FKBPF36V-mEGFP-IRF1-NES大大过量(图S4)。在用NICE-01(250 nM)处理并表达FKBPF36V-mEGFP-IRF1-NES的293T细胞中,RNA-seq显著上调IRF1-ChIP-seq靶点(图4a)。通过基因集富集分析,作者还观察到标志性干扰素反应基因集的显著阳性富集(图4b)。这些结果表明化学诱导BRD4定位于胞质转录因子足以诱导其靶基因的表达。 (图片来源:J. Am. Chem. Soc.) 总结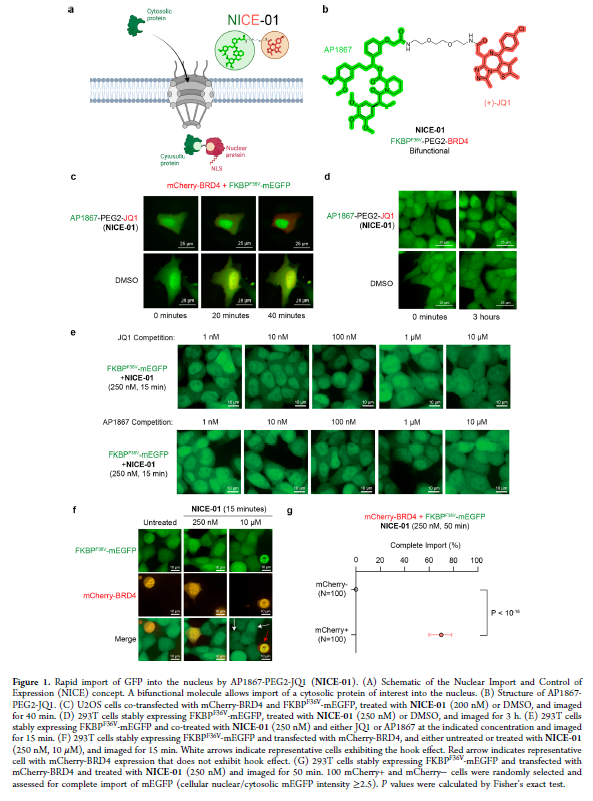
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn