

(图片来源:J. Am. Chem. Soc.)
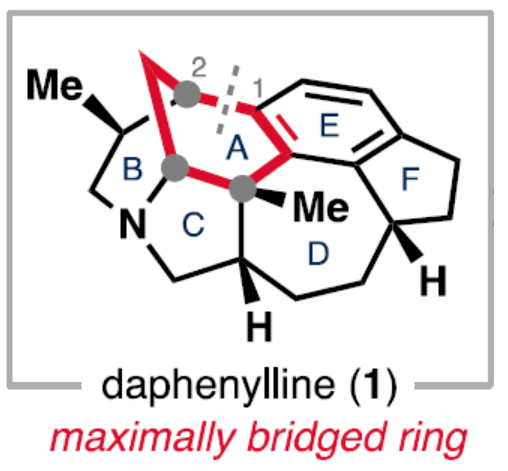
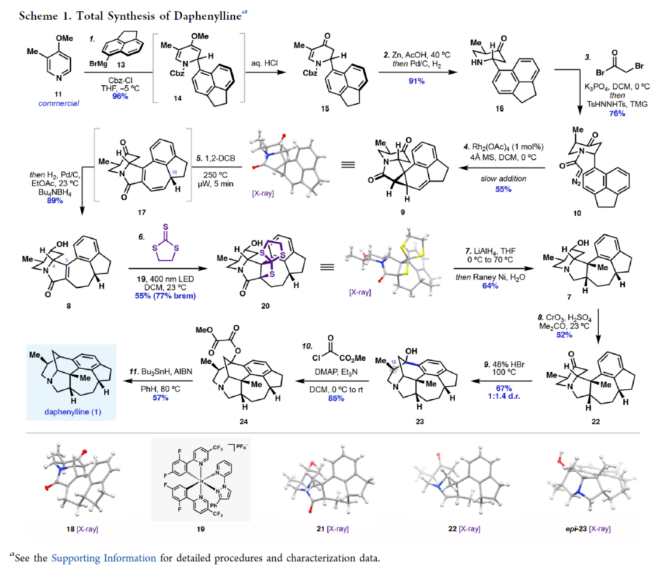
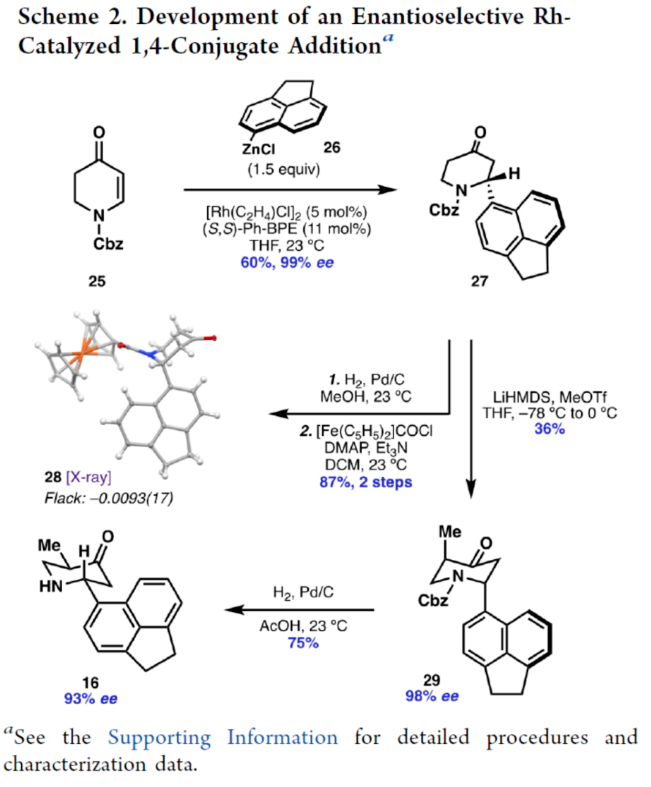
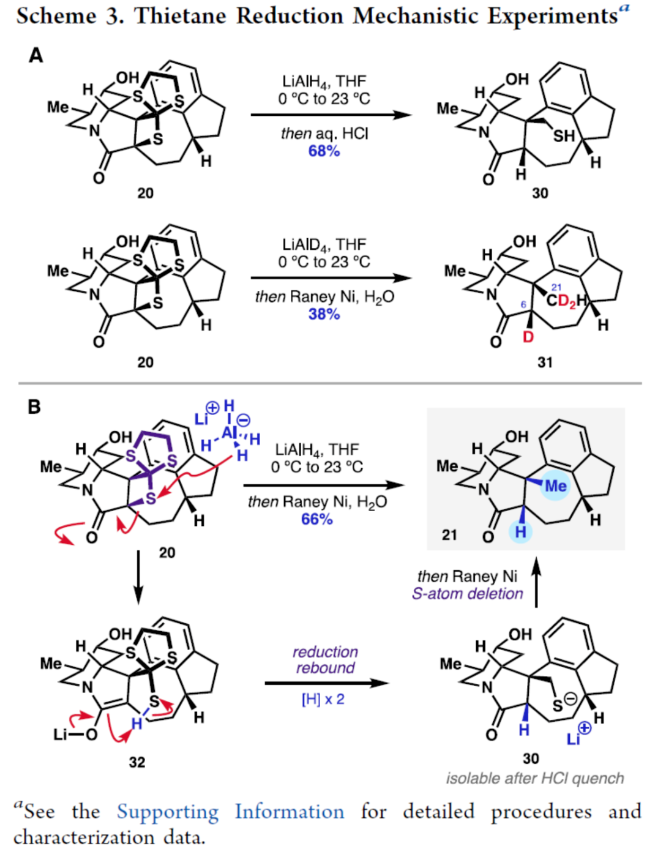
正文 前期,化学家们已经实现了几种虎皮楠属(Daphniphyllum)生物碱的全合成(Figure 1A)。其中,从长序虎皮楠(Daphniphyllum longeracemosum)果实中发现的Daphenylline(1),已经成为许多合成方法的主题。在结构上,Daphenylline(1)具有一个2-氮杂双环[3.3.1]壬烷核,附加在一个特征的5-7-5环骨架上,并包含六个立体中心、一个全碳季碳中心和一个稠合的苯(环)型(benzenoid)核,这在其生物合成相关的Calyciphylline A-型同源物中是独特的。下载化学加APP到你手机,收获更多商业合作机会。 通过对Daphenylline(1)的逆合成分析发现(Figure 1B),1可由五环中间体(7)经阳离子芳基化制备。五环中间体7可以简化为α,β-不饱和内酰胺8,通过共轭加成引入必要的全碳季碳中心。砌块8中的七元环可由砌块9经6π-电环开环反应制备。砌块9可由α-芳基化哌啶酮10经Buchner环加成制备。α-芳基化哌啶酮10可由市售的吡啶衍生物11和苊12经去芳构化吡啶鎓芳基化制备。 (图片来源:J. Am. Chem. Soc.) (±)-Daphenylline(1)的全合成(Scheme 1):吡啶衍生物11在CBz-Cl条件下活化后,加入苊Grignard试剂13,并在酸性条件下进行水解,可以96%的收率得到二氢吡啶酮中间体15。中间体15在Zn/AcOH条件下进行烯基的还原,并在Pd/C/H2条件下进行脱保护,可以91%的收率得到中间体16。中间体16与溴乙酰溴在K3PO4/DCM条件下进行N-乙酰化反应,并在TsHNNHTs/TMG条件下分别进行双对甲苯磺酰肼加成与TMG-介导的双重亚硫酸酯消除,可以76%的收率得到重氮乙酰胺中间体10。通过反应条件的优化后发现,中间体10在Rh2(OAc)4/4Å MS/DCM条件下进行分子内Buchner反应,可以55%的收率得到中间体9,其结构通过X-射线晶体学分析进行了表征。同时,在Buchner反应中,需缓慢加入中间体10,可减少均二聚(homodimerization)副反应的生成。严格干燥的溶剂还通过防止不需要的O−H键插入产物来提高9的收率。通过对反应条件的优化后发现,中间体9在1,2-DCB/250 oC条件下进行热解生成环庚二烯中间体17,中间体17在H2/Pd/C/EtOAc/Bu4NBH4条件下进行氢化与还原反应,可以89%的收率得到中间体8。基于大量文献的总结以及多种反应的尝试后发现,中间体8在三硫代碳酸乙烯酯在蓝色400 nm LED/DCM条件下进行thia-Paternò-Büchi [2 + 2]光环加成反应,可以55%的收率得到螺环硫化环丙烷中间体20,其结构通过X-射线晶体学分析进行了表征。重要的是,这种转化只生成了head-to-tail的产物,将新形成的C-C键置于所需的β-位。通过反应条件的优化后发现,中间体20在LiAlH/THF条件下进行还原,并在Raney Ni/H2O条件下进行脱硫反应,可以64%的收率得到吡咯烷中间体7。中间体7在CrO3/H2SO4/Me2CO条件下进行二级醇的氧化反应,可以52%的收率得到酮中间体22。中间体22在48% HBr/100 oC条件下进行还原,可以67%的收率得到氮杂双环[3.3.1]壬烷中间体23,dr为1:1.4。中间体23与酰氯衍生物在DMAP/Et3N/DCM条件下进行酰化反应,可以85%的收率得到中间体24。中间体24在Bu3SnH/AlBN/PhH条件下进行Barton-McCombie还原反应,可以57%的收率得到(±)-Daphenylline(1)。 (图片来源:J. Am. Chem. Soc.) 在实现了外消旋Daphenylline(1)的全合成后,作者对其的对映选择性版本进行尝试(Scheme 2)。二氢吡啶酮25与芳基锌试剂26在[Rh(C2H4)Cl]2/(S,S)-Ph-BPE条件下进行1,4-共轭加成反应,可以60%的收率得到哌啶酮中间体27,ee为99%。将所得的对映体富集的吡啶酮衍生为二茂铁酰胺,可以通过X-射线晶体学确认绝对构型,Flack参数接近零。中间体27与MeOTf在LiHMDS/THF条件下进行α-甲基化反应,可以36%的收率得到中间体29,ee为98%。中间体29在H2/Pd/C/AcOH条件下进行氢解,可以75%的收率得到中间体16,ee为93%,其作为合成(-)-1的中间体。 (图片来源:J. Am. Chem. Soc.) 随后,作者对硫化环丙烷还原机理实验进行了研究(Scheme 3)。首先,化合物20在使用LiAlH4处理后,再用HCl淬灭,可生成硫醇化合物30,表明了该硫醇是在Raney镍脱硫之前原位形成的。其次,为了探索syn-立体化学结果的来源和氢化物源的作用,作者使用LiAlD4进行了同位素标记实验。实验结果表明,氢介导的硫化环丙烷开环,而不是脱硫步骤,是C6-处质子引入的原因(因此也是由此产生的syn-立体化学)。总之,作者认为,LiAlH4进攻硫化环丙烷化合物20上的张力硫原子,得到烯醇化物32,烯醇化物在“reduction-rebound”机理序列中通过侧链上的硫醇进行动力学质子化。在原甲酸硫代酯完全还原为伯硫醇化合物30后,用Raney镍脱硫得到化合物21。该转化最终通过两个步骤实现了不饱和内酰胺8的形式syn-加氢甲基化,这是由thia-PaternoÉ-Buïchi[2+2]光环加成和LiAlH4-介导的reduction-rebound转化的立体特异性所独特实现的。 (图片来源:J. Am. Chem. Soc.) 总结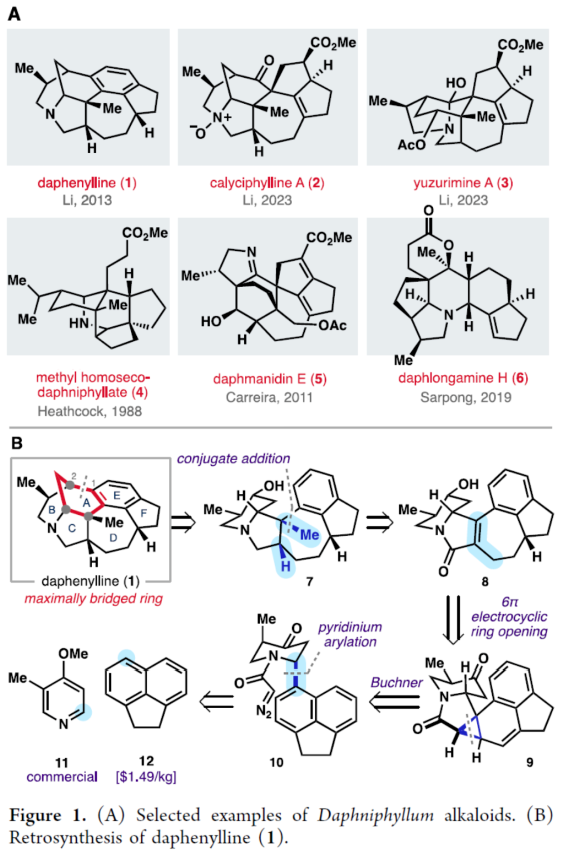
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn