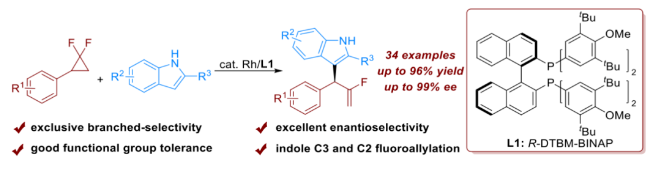
有机氟化物在药物化学和材料科学领域中扮演着至关重要的角色。在众多含氟结构单元当中,单氟烯烃因其在生物活性分子修饰中作为酰胺或烯醇类似物的巨大应用潜力而受到合成领域的持续关注。偕二氟环丙烷(gem-DFCPs)通过过渡金属催化氟烯丙基偶联反应转化为其他含氟分子,尤其是单氟烯烃已经取得了很大的进展,这些产物以直链选择性为主(图1a)。目前,从偕二氟环丙烷出发,通过3,3′-重排 (图1b,上)和3,4′-氢迁移(图1b,下)策略成功实现了支链选择性的消旋单氟烯烃化合物的合成。然而,该方法仅局限于π-共轭的双位点亲核试剂,比如烯丙基硼酯、酮和腙等,并且只能利用偕二氟环丙烷作为氟烯丙基前体来合成消旋的单氟烯烃。这种对映选择性反应面临的主要挑战在于亲核试剂通常倾向于直链选择性,主要是因为在以偕二氟环丙烷为前体的烯丙基金属中间体中,位阻较小的碳原子更容易被亲核进攻。因此,挑战这种固有的反应性,能够推动偕二氟环丙烷不对称烯丙基偶联反应的发展,从而实现单氟烯烃的对映选择性合成。下载化学加APP到你手机,收获更多商业合作机会。夏莹研究员团队前期一直致力于过渡金属催化(含氟)小环化学的研究(Angew. Chem. Int. Ed. 2021, 60, 10626; ACS Catal. 2022, 12, 8857; Chem. Sci. 2022, 13, 12419; Angew. Chem. Int. Ed. 2023, 62, e202304462; Angew. Chem. Int. Ed. 2023, 62, e202307129; Angew. Chem. Int. Ed. 2024, 63, e202319647; Adv. Sci. 2024, 11, 2401243)。近日,四川大学夏莹课题组实现了首例铑催化偕二氟环丙烷与吲哚的烯丙基偶联反应,以优异的支链选择性和对映选择性得到了吲哚取代的α-单氟烯烃产物(图1c)。具体而言,大位阻双齿膦配体的使用是取得高对映选择性的关键,该反应具有广泛底物兼容性和优异官能团耐受性,为手性单氟烯丙基吲哚的合成提供了一个高效且通用的策略。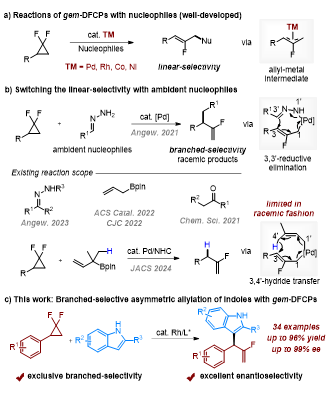
图1.偕二氟环丙烷参与的区域选择性开环烯丙基化反应
(图片来源:Angew. Chem. Int. Ed.)在条件筛选过程中,作者考察了不同的银盐添加剂和溶剂对反应的影响,以及如何控制区域选择性。有趣的是,在配体筛选中,作者发现空间位阻更小的配体,比如L2和L3,有利于形成具有R构型的产物3a,而随着双齿配体上空间位阻的增加(L1和L4),产物3a产生了ee值从低到优异的S构型的趋势,并最终得到主要构型为S,ee值93%的产物3a(图2)。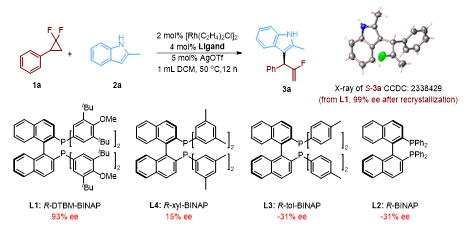
通过对反应条件的优化,作者发现苯基取代的偕二氟环丙烷和2-甲基取代的吲哚在铑和大位阻配体L1作为催化剂的条件下,能够以93%的收率,93% ee值和38:1的支链选择性得到氟烯丙基化的吲哚3a, 通过单晶衍射实验对3a的结构进行了确认,并在此最佳条件下探索了该反应的底物范围(图3)。作者首先考察了偕二氟环丙烷底物的官能团兼容性,发现偕二氟环丙烷上芳基的电性对反应的影响较小。间位和对位卤素取代的苯基、邻位取代的苯基、多取代苯基、稠芳和苯并杂环都能被很好地兼容。广泛的官能团兼容性同样适合于各位点取代的2-甲基吲哚,均能以令人满意的产率、对映选择性和支链选择性得到预期产物。此外,该反应的底物范围还能拓展到吲哚含氮部分,包括普通吲哚和多取代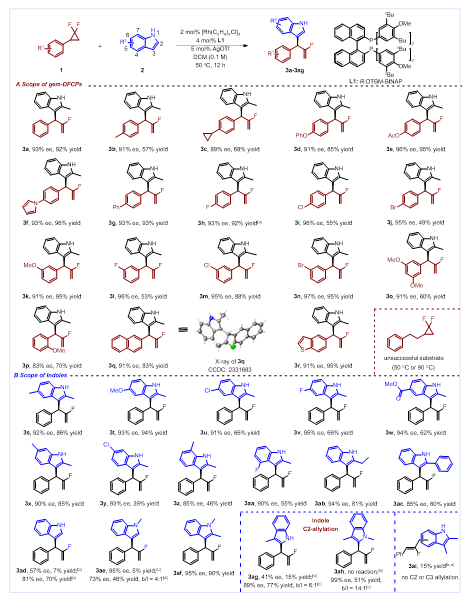
图3. 底物范围考察
(图片来源:Angew. Chem. Int. Ed.)(1,2-或1,3取代-)的吲哚,以中等到较高产率和ee值得到多样化的吲哚不对称烯丙基化的产物。其中,3-取代和1,3-二取代的吲哚均能得到吲哚C2的不对称烯丙基化产物,而普通吲哚(3ad)、N-甲基取代的吲哚(3ae)和3-甲基吲哚(3ag)在大位阻配体L1条件下转化率很低,而换成位阻更小的L2或L5,则能得到选择性非常好的目标产物。同时,作者也发现部分底物在当前反应条件下不能产生预期的产物,如烷基取代的偕二氟环丙烷和2,3-二甲基取代的吲哚(3ai)。作者考察了该反应在有机合成中的实用性(图4)。对2-甲基取代的吲哚和1,2-二甲基取代的吲哚进行了放大实验,其产率与选择性与小量反应类似。此外,基于碳氟键的Kumada 类型偶联反应,可以将产物中的碳氟键转化为相应的芳基化偶联产物4。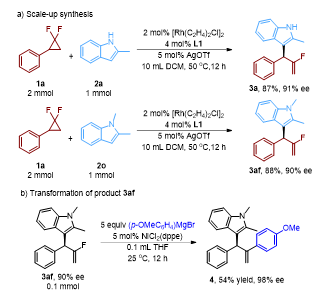
图4. 合成应用
(图片来源:Angew. Chem. Int. Ed.)最后,作者通过一系列机理实验,包括偕二氟环丙烷的回收(图5a)、不同配体条件下对回收的偕二氟环丙烷的反应性考察(图5b)以及对其他苯并杂环的考察(图5c),结合配体筛选时观察到的结果,提出了可能的反应机理(图5d)。首先,反应通过氧化加成实现C−C键活化,接着通过β−F消除进行C−F键的活化,并通过烯丙基偶联反应形成新的C−C键。鉴于氧化加成和β−F消除过程均为立体保持,并且观察到反应净结果也是立体保持的,因此作者推测第三步的烯丙基偶联过程也应该是立体保持。该立体保持烯丙基化过程可能通过球内亲电C−H键金属化/还原消除过程,或者通过烯丙基铑中间体的专一立体翻转,然后进行球外烯丙基取代反应实现。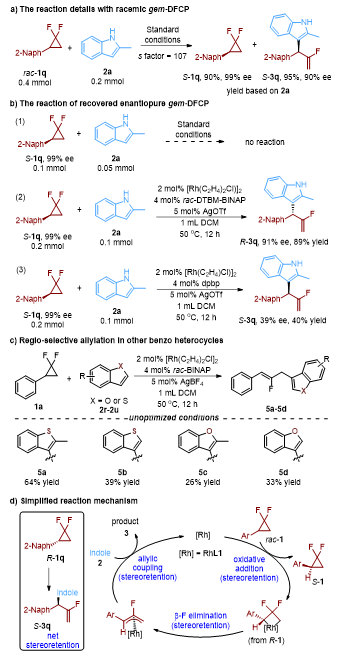
图5. 机理实验和由此推测的催化循环
(图片来源:Angew. Chem. Int. Ed.)
综上所述,作者发展了一种铑催化吲哚与偕二氟环丙烷优异支链和对映选择性的烯丙基偶联反应。该反应是第一个在偕二氟环丙烷的开环偶联中同时具有高对映选择性和高支链区域选择性的例子,不仅具有广泛的底物范围,并且能够高效生成多种取代的吲哚C2和C3氟烯丙基化产物,放大实验和应用也证明了该方法在有机合成中的应用潜力。该团队目前正致力于解释这一偶联反应的立体化学和支链区域选择性。
Rhodium-Catalyzed Enantio- and Regioselective Allylation of Indoles with gem-Difluorinated Cyclopropanes
本文的第一作者是四川大学硕士研究生杨慧,通讯作者为四川大学华西公共卫生学院(华西第四医院)/生物治疗全国重点实验室夏莹研究员。
Angewandte Chemie International Edition DOI: 10.1002/anie.202403602
夏莹研究员简介
夏莹,四川大学华西生物治疗国家重点实验室和华西公共卫生学院/华西第四医院研究员、博士生导师,公共卫生与预防医学实验中心主任。2010年本科毕业于北京理工大学。2010年至2015年在北京大学王剑波教授、张艳教授课题组攻读博士学位。2015年至2019年先后在美国德州大学奥斯汀分校和芝加哥大学Guangbin Dong(董广彬)教授课题组从事博士后研究工作。2019年加入四川大学开展独立研究工作,研究兴趣为过渡金属催化的小环化学、不对称催化和有机氟化学,目前所有文章(含合作)被引>5000次,h-index为36 (Scopus数据库),获得 2022 年 Thieme Chemistry Journals Award国际学术奖。课题组主页:https://www.x-mol.com/groups/SCU-Xia_Ying。








