

(图片来源:Nat. Catal.)
正文
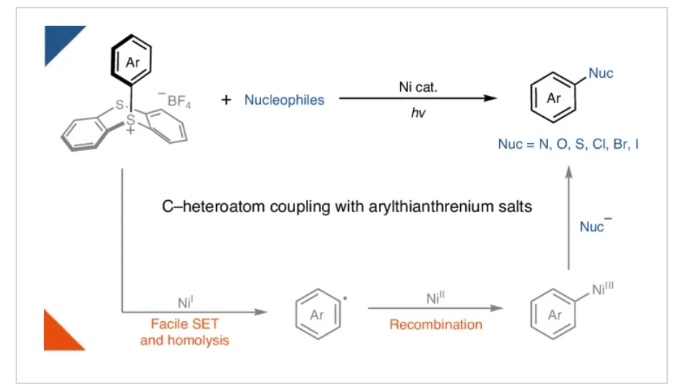
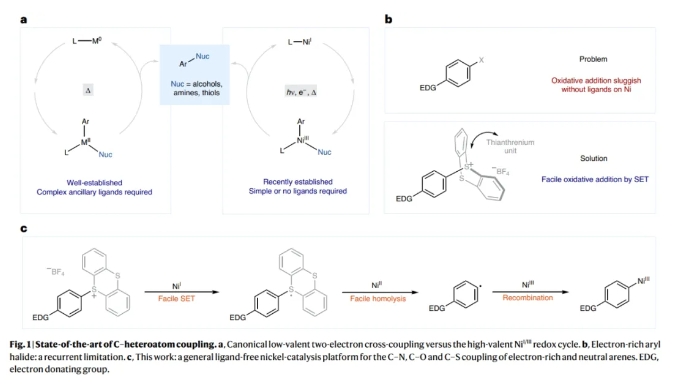
镍光氧化还原催化使利用过渡金属催化构建碳-杂原子键的转化丰富发展。通过利用光能,过渡金属可以达到在催化反应中通过热化学难以达到的氧化态。例如,已被报道利用镍光氧化还原反应利用芳基(拟)卤化物合成苯胺和芳基醚。然而,在缺乏特殊的富电子配体的情况下简单镍体系的氧化加成通常很慢,会导致催化剂分解。因此,富电子芳基亲电试剂通常不能实现上述转化。最近,德国马克斯·普朗克煤炭研究所Josep Cornella和Tobias Ritter课题组提供了一个概念性的解决方案,在光/镍共催化下实现了富电子芳环(芳基噻蒽鎓盐)的胺化,氧化,硫化和卤化过程,同时构建了碳-杂原子键(Fig. 1)。化学加——科学家创业合伙人,欢迎下载化学加APP关注。
(图片来源:Nat. Catal.)
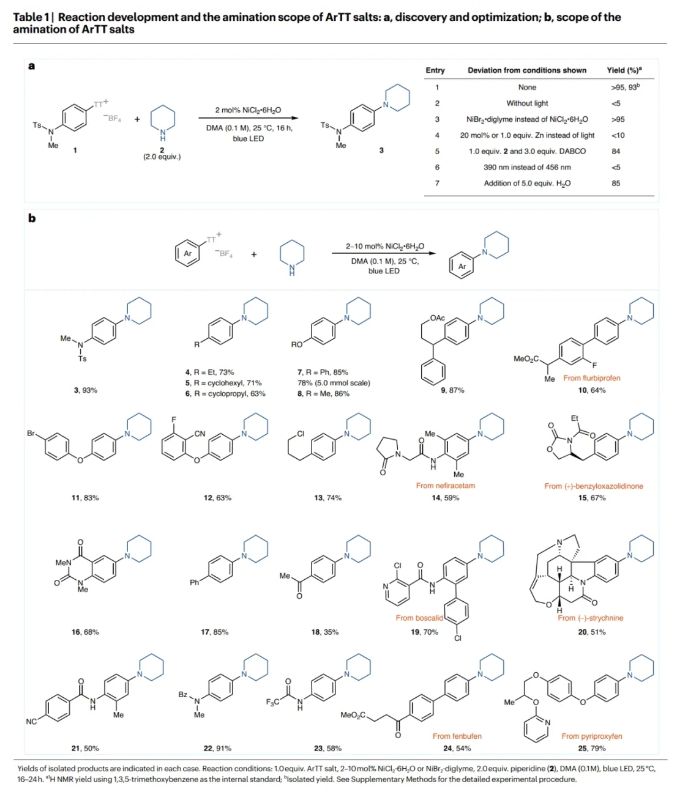
首先,作者以芳基噻蒽鎓盐1和哌啶2作为模板底物对反应进行了探索(Table 1a)。通过一系列条件筛选,作者发现当使用1(1.0 equiv),2(2.0 equiv),2 NiCl2·6H2O(2 mol%),在DMA (0.1 M)中,蓝光照射下25 °C反应16小时,可以以大于95%的核磁产率和93%的分离产率得到相应的C-N偶联产物3 (entry 1)。2023年,作者报道了无需光参与的镍催化卤化反应,其中锌被用作还原剂(J. Am. Chem. Soc. 2023, 145, 9988)。但是,即使使用1.0当量的锌在此转化中也仅能产生不到10%的产物3(entry 4)。由此表明此体系与之前的反应体系有所不同。
在得到了最优反应条件后,作者对此转化的底物范围进行了考察(Table 1b)。实验结果表明,一系列不同取代的富电子和电中性的芳基噻蒽鎓盐均可顺利实现转化,以50-93%的产率得到相应的产物3-25。与其它的镍催化胺化策略相比,缺电子底物的反应效率相对较低(18)。通常来讲缺电子芳烃的氧化加成会更快,但可能是由于竞争的氢化副反应的存在使得目标产物产率降低。一系列不同的官能团,包括磺酰胺、酰胺、环丙基、醚、联芳基、卤化物、腈、酯、杂环、氨基甲酸酯和胺等均可兼容。此外,一系列复杂的活性小分子,如flurbiprofen (10), nefiracetam (14), benzyloxazolidinone (15), boscalid (19), strychnine (20), fenbufen (24) 和 pyriproxyfen (25)也均可以转化为相应的胺化产物,这为生物活性分子为后期修饰提供了一个新的策略。虽然对位和间位取代的底物可以参与反应,但邻位取代的芳基噻蒽鎓盐不能实现转化,得到的大部分是氢化的副产物以及未反应的起始材料。
(图片来源:Nat. Catal.)
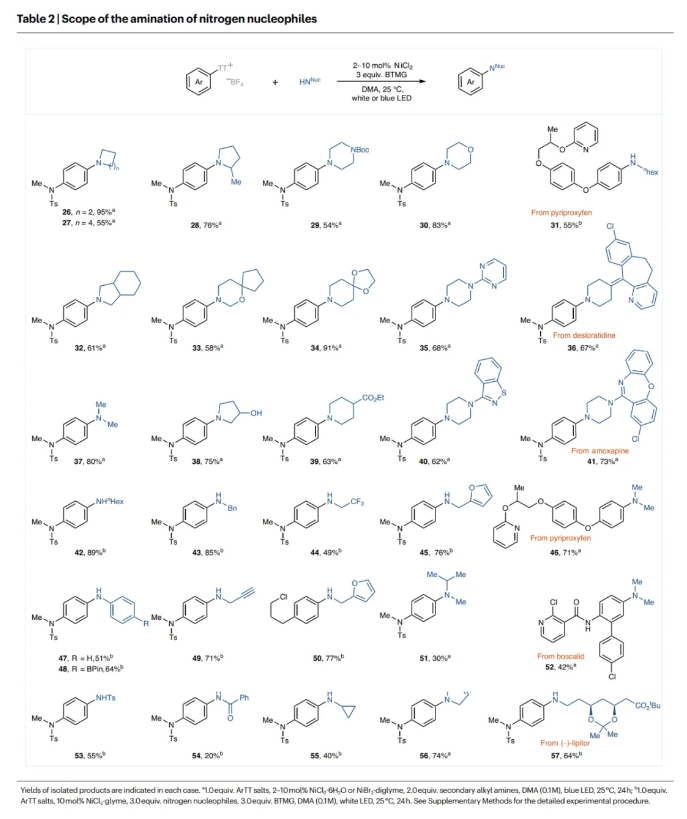
接下来,作者对N-亲核试剂的底物范围进行了考察(Table 2)。一系列不同尺寸的环二级胺,如α-甲基取代的吡咯烷,N-Boc保护的哌嗪,吗啡啉,嘧啶和苯并异噻唑胺等均可兼容。此外,二甲胺也可有效参与转化,以80%的产率得到目标产物37。然而,当使用比二甲胺具有更大空间位阻的线性二级胺时,产率会有所下降(51)。产率较低的原因可能是由于位阻减缓了反应,并在与镍催化剂配位时引起了β-H的消除。然而,当加入3.0当量2-叔丁基-1,1,3,3-四甲基胍(BTMG),并将镍源切换为NiCl2·glyme(10 mol%)时,伯胺也可以参与反应,得到所需的产物。虽然蓝色LED也很有效,但在伯胺反应的情况下,白光LED的产率略高。环丙胺、丙胺、α-CF3取代胺和含呋喃环的伯烷基胺均可参与反应,以40-89%的产率得到产物。值得注意的是,具有在钯催化的胺化反应中容易发生副反应的官能团的底物在此反应条件下也是耐受的。此外,酸性官能团(OH)也是可以兼容的(38)。
(图片来源:Nat. Catal.)
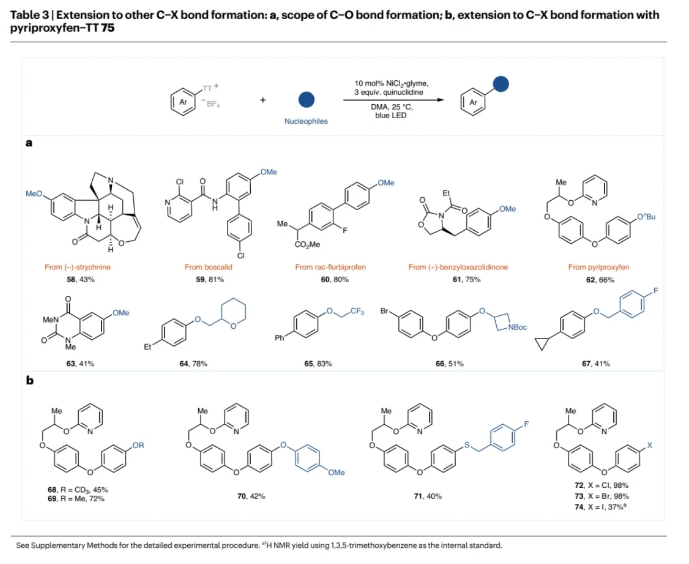
接下来,作者将所开发的催化剂体系扩展到以MeOH为亲核试剂的甲氧基化过程(Table 3)。无论简单的和复杂官能团化的含烷基、卤素、酰胺、杂环和酯的芳基噻蒽鎓盐以及伯醇、仲醇和酚均可参与这一过程,以41-83%的产率得到相应的产物58-67。虽然之前已经报道过使用芳基噻蒽鎓盐构建C−O键的转化,但这些转化并不是催化过程,并且需要使用化学计量的铜。此外,对于卤化过程,需要使用非均相的锌粉来形成Ni(I)催化剂,这可能会在大规模合成中带来不便。此外,文献报道的C−S键的形成过程仅限于芳香硫醇,而烷基硫醇则不能实现转化。在此情况下,作者利用目前的方案克服了这些限制,并为使用氮,氧和硫亲核试剂的转化提供了统一的方法。此外,碘化钠、溴化钠和四丁基氯化铵(TBACl)也同样可以作为亲核试剂在来实现卤化,这为类药分子的后期官能团化提供了一种直接和简单的方法。遗憾的是,此转化迄今为止尚未扩展到氟化过程。
(图片来源:Nat. Catal.)
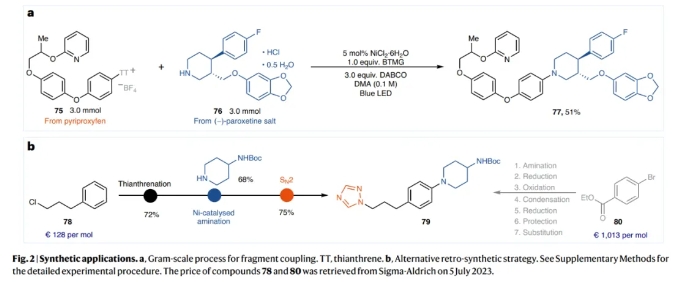
为了证明此转化的实用性,作者对pyriproxyfen和(−)-paroxetine 盐这两个药物分子进行了克级规模(3.0 mmol)偶联,可以以51%的产率得到产物77(Fig 2a)。利用之前的方法,化合物79通常以芳基溴80为起始原料,经过7步合成得到。而利用此策略可以从芳基噻蒽鎓盐78开始,通过胺化和亲核取代(SN2)反应,并且能够将合成简化为三步来实现合成(Fig 2b)。
(图片来源:Nat. Catal.)
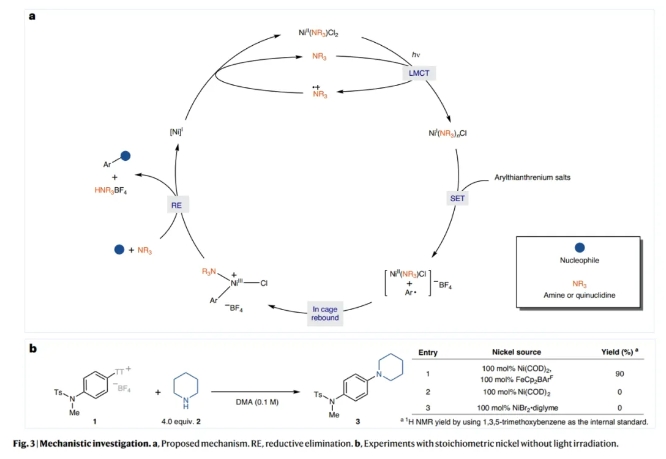
基于上述实验结果,作者提出了可能的反应机理(Fig 3a):反应中Ni(I)可能是由简单的Ni(II)盐,在光照射下通过配体到金属的电荷转移(LMCT)过程生成的。当1和2的混合物与Ni(COD)2 (100 mol%)和单电子氧化剂FeCp2BArF (100 mol%)在黑暗中结合时,C-N键产物3的产率为90%,由此进一步证明了Ni(I)物种的存在(Fig 3b)。随后,芳基噻蒽鎓盐通过SET氧化加成以及再结合得到Ni(III)中间体,并经历还原消除得到产物并再生Ni(I)物种,进入新的催化循环。
(图片来源:Nat. Catal.)
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn