

(图片来源:J. Am. Chem. Soc.)
正文
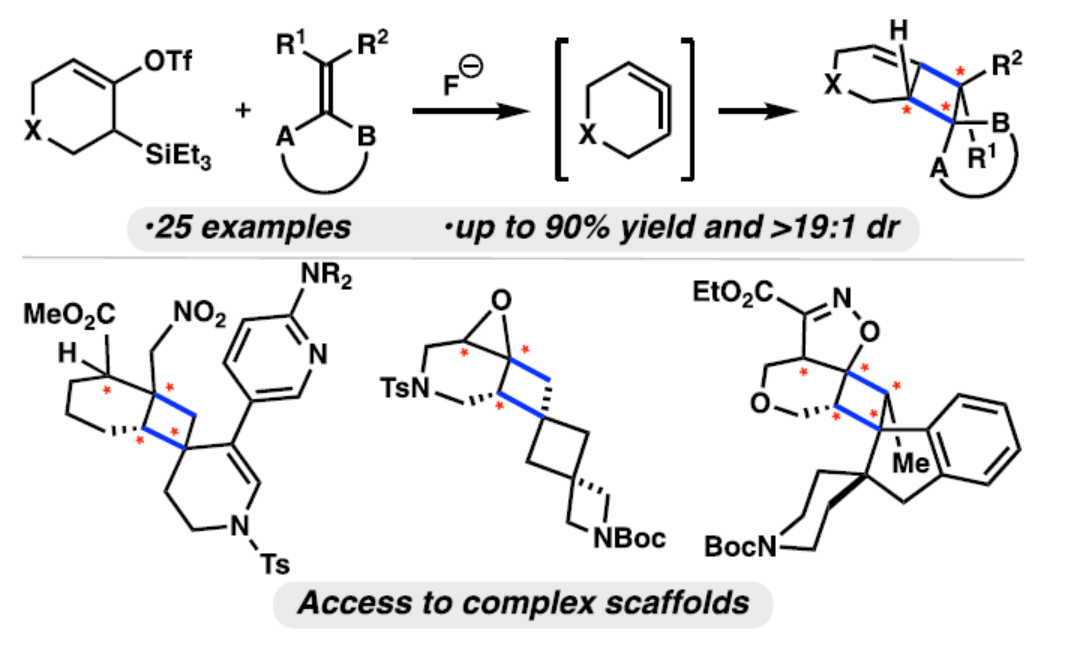
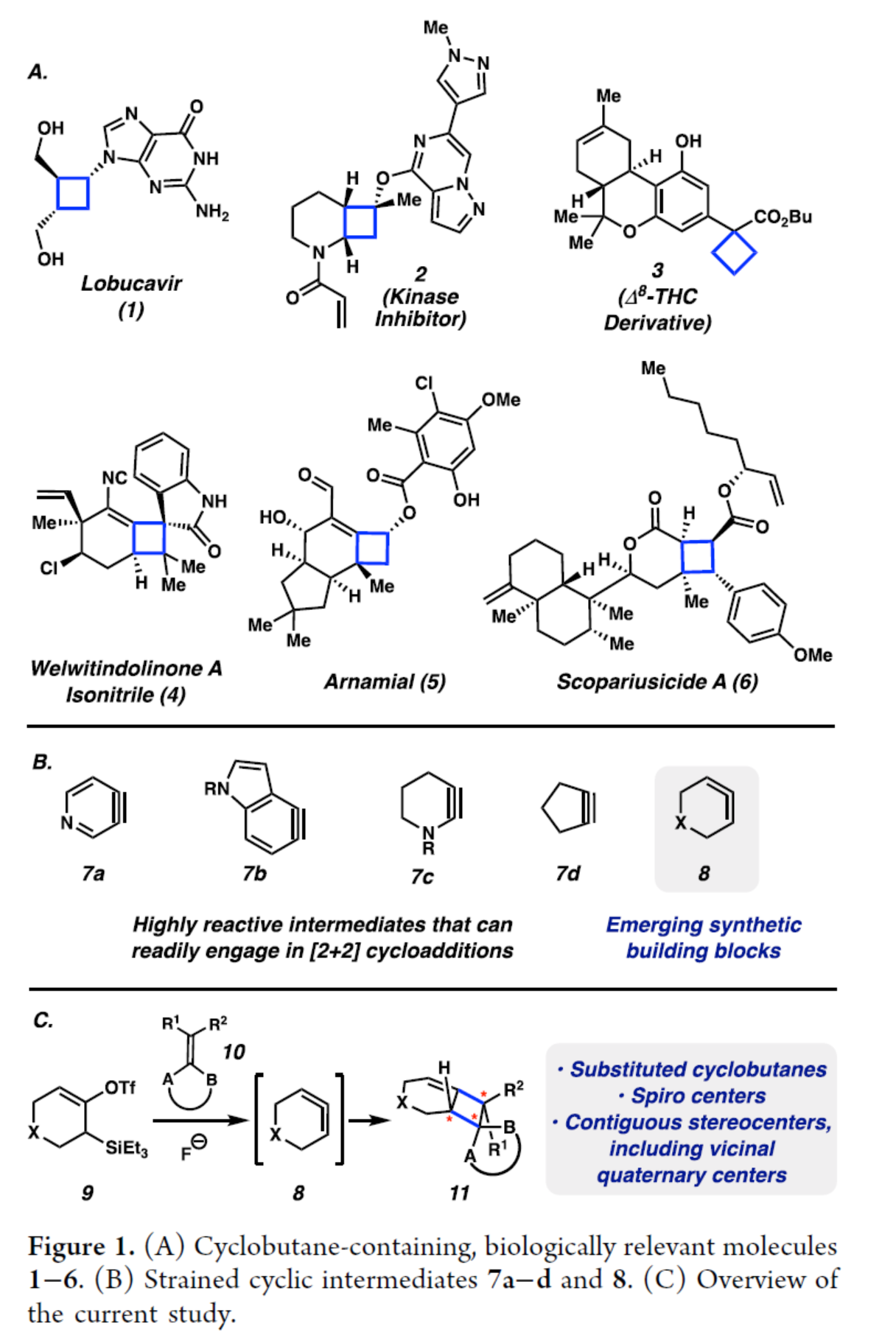
含有取代环丁烷单元的化合物广泛存在于天然产物和生物活性分子等中,例如抗病毒药物Lobucavir(1)、激酶抑制剂(2)、大麻素(3)、Welwitindolinone A isonitrile(4)、Arnamial(5)和Scopeusicide A(6)(Figure 1A)。目前,通过使用含有环丁烷单元的原料或环加成反应是引入环丁烷的常用方法。最近,化学家们开发了几种优雅的引入环丁烷的方法。其中,光化学[2+2]环加成是最常见的方法,其利用原位生成的光激发中间体。然而,利用这些中间体进行区域和立体选择性的分子间反应极具难度,常需使用专门的试剂或催化剂。因此,合成具有多个手性中心的高度官能团化环丁烷的新方法,仍有待进一步的探索。此外,利用张力促进策略也是合成高度官能团化环丁烷的有效方法(Figure 1B)。例如,芳炔(7a和7b)、非芳香族环炔烃(7c和7d)是一种高度反应性中间体,易参与[2+2]环加成反应。然而,对于张力环状联烯(8)参与的环加成反应,目前却较少有相关的研究报道。近日,美国加利福尼亚大学洛杉矶分校的Neil K. Garg课题组报道了一种张力诱导环状联烯的[2+2]环加反应,合成了一系列高度取代的环丁烷衍生物(Figure 1C)。其中,通过氟介导的硅基三氟甲磺酸酯9的1,2-消除生成的环状联烯8,其可与高度取代的烯烃10发生环加成反应,生成高度官能团化的环加合物11,一步形成两个新的C−C键。此外,通过选择不同的捕获剂,可获得含有杂原子、稠环、连续手性中心、螺环和季碳中心的复杂骨架。并且,该策略无需使用金属、Lewis酸或Brønsted酸催化剂,也不需要导向或辅助基团。化学加——科学家创业合伙人,欢迎下载化学加APP关注。
(图片来源:J. Am. Chem. Soc.)
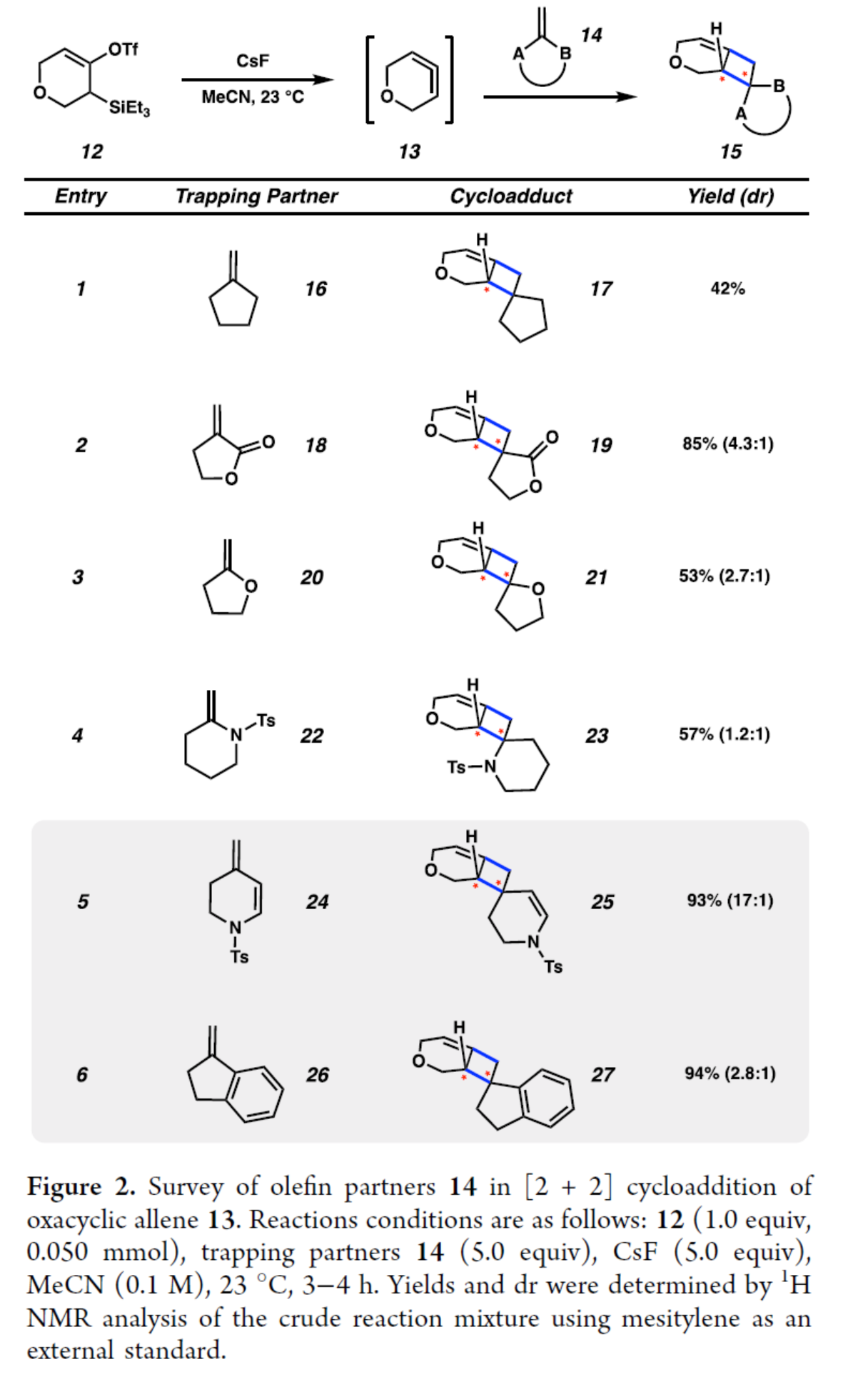
首先,作者以氧杂联烯13为模型底物,对烯烃的底物范围进行了扩展(Figure 2)。非活化环外烯烃(16),可以42%的收率得到环加成产物17。含有α,β-不饱和内酯的缺电子烯烃(18),可以85%的收率得到产物19,dr为4.3:1。含有杂原子的富电子烯烃(20、22和24),也能够顺利进行反应,获得相应的产物21、23和25,收率为53-93%,dr为1.2:1-17:1。苯乙烯衍生物(26),也是合适的底物,可以94%的收率得到产物27,dr为2.8:1。
(图片来源:J. Am. Chem. Soc.)
其次,作者对双烯胺底物的范围进行了扩展(Figure 3)。通过对反应条件的优化后发现,Bu4NOTf可以提高氟离子在有机溶剂中的溶解度,有利于反应的进行。N-Ts与N-Boc取代的双烯胺底物(24和30),均可顺利进行反应,可获得相应的产物25(收率为83%,dr为17:1)和31(收率为82%,dr为15:1)。四氢氮杂䓬衍生物(32),可以88%的收率得到产物33,dr为10:1。含有取代的二烯胺底物(34和36),可获得相应的产物35(收率为72%,dr为2.2:1)和37(收率为81%,dr>19:1)。值得注意的是,产物35具有三个连续的手性中心。碘取代的底物(38),可以78%的收率得到产物39,dr为18:1。含有偕-二甲基取代的底物(40),可以85%的收率得到产物41,dr为1.5:1。

(图片来源:J. Am. Chem. Soc.)
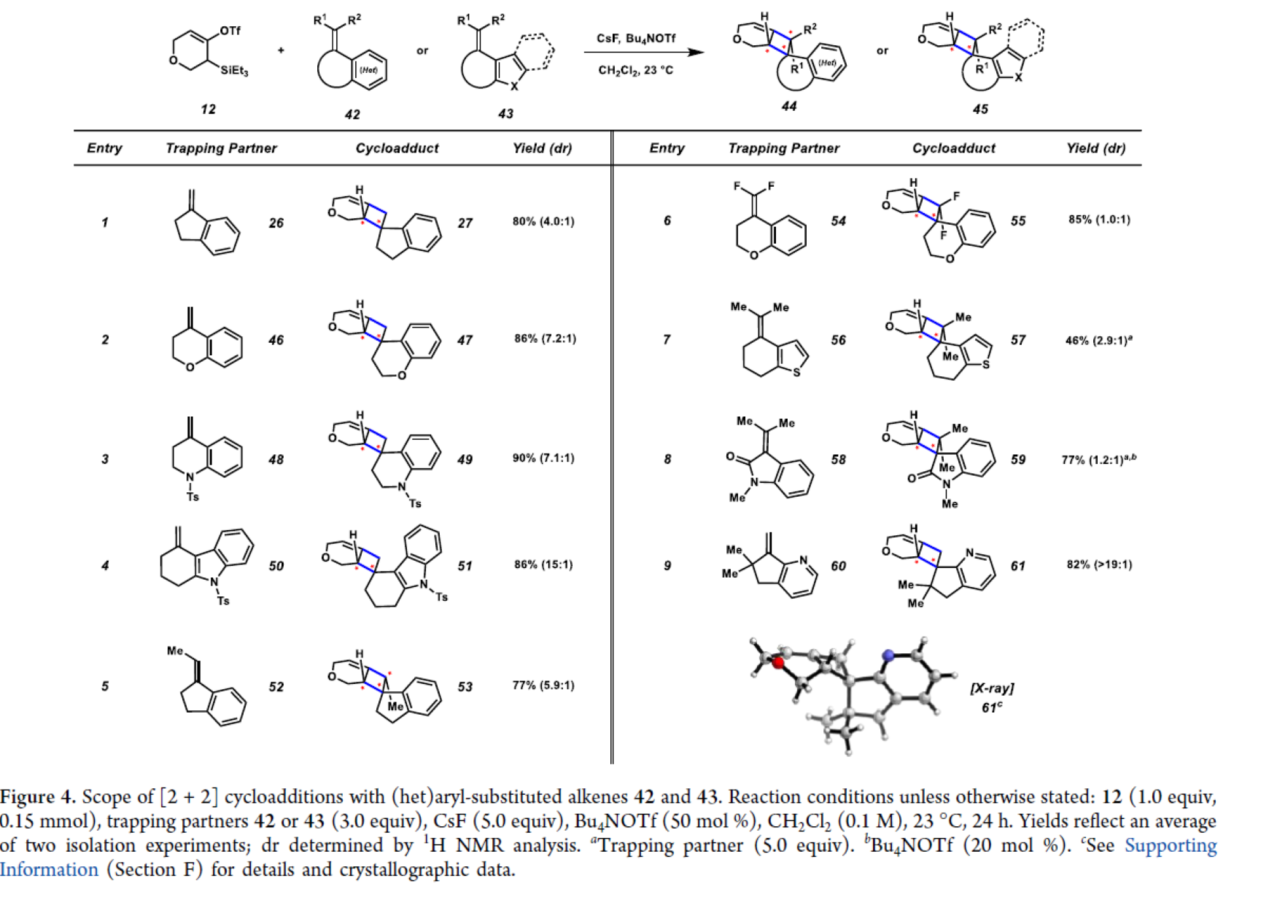
紧接着,作者对(杂)芳基取代的烯烃的底物范围进行了扩展(Figure 4)。苯乙烯衍生物(26),可以80%的收率得到产物27,dr为4.0:1。具有六元杂环的底物(46和48),可获得相应的产物47(收率为86%,dr为7.2:1)和49(收率为90%,dr为7.1:1)。多环取代的底物50,可以86%的收率得到产物51,dr为15:1。三或四取代烯烃底物(52、54、56和58),也能够顺利进行反应,获得相应的产物53、55、57和59,收率为46-85%,dr为1.0:1-5.9:1。其中,产物53具有三个连续的手性中心,产物55、57和59具有相邻的季碳中心。含有偕-二甲基单元的吡啶基取代的烯烃底物(60),可以82%的收率得到产物61,dr>19:1,其结构通过X-射线晶体学进行了验证。
(图片来源:J. Am. Chem. Soc.)
随后,作者还对碳环联烯的底物范围进行了扩展(Figure 5)。硅基三氟甲磺酸酯衍生物(62和65)在CsF/MeCN条件下,可分别生成六元环中间体(63)与七元环中间体(66),通过进一步的反应,可获得相应的产物64(收率为75%,dr为7.1:1)和67(收率为24%,dr为5.9:1)。然而,对于较小的五元环底物,未能有效的进行反应。
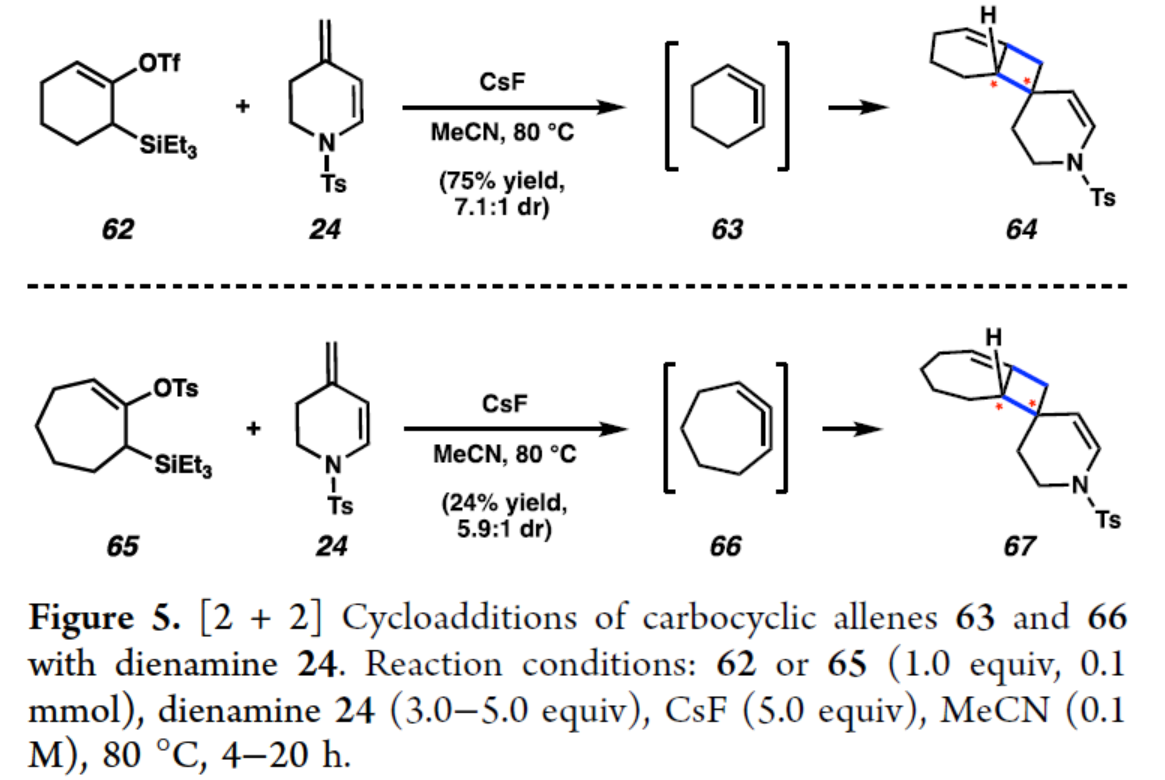
(图片来源:J. Am. Chem. Soc.)
此外,作者对产物的热异构化进行了研究(Figure 6)。研究结果表明,该异构化可能通过C6和C4′之间张力键的热均裂发生(见底物25),然后是自由基重组,最终达到两种异构体之间的热力学平衡。并且,在上述环状联烯的[2+2]捕获反应中观察到的选择性,反映了产物的动力学分布。
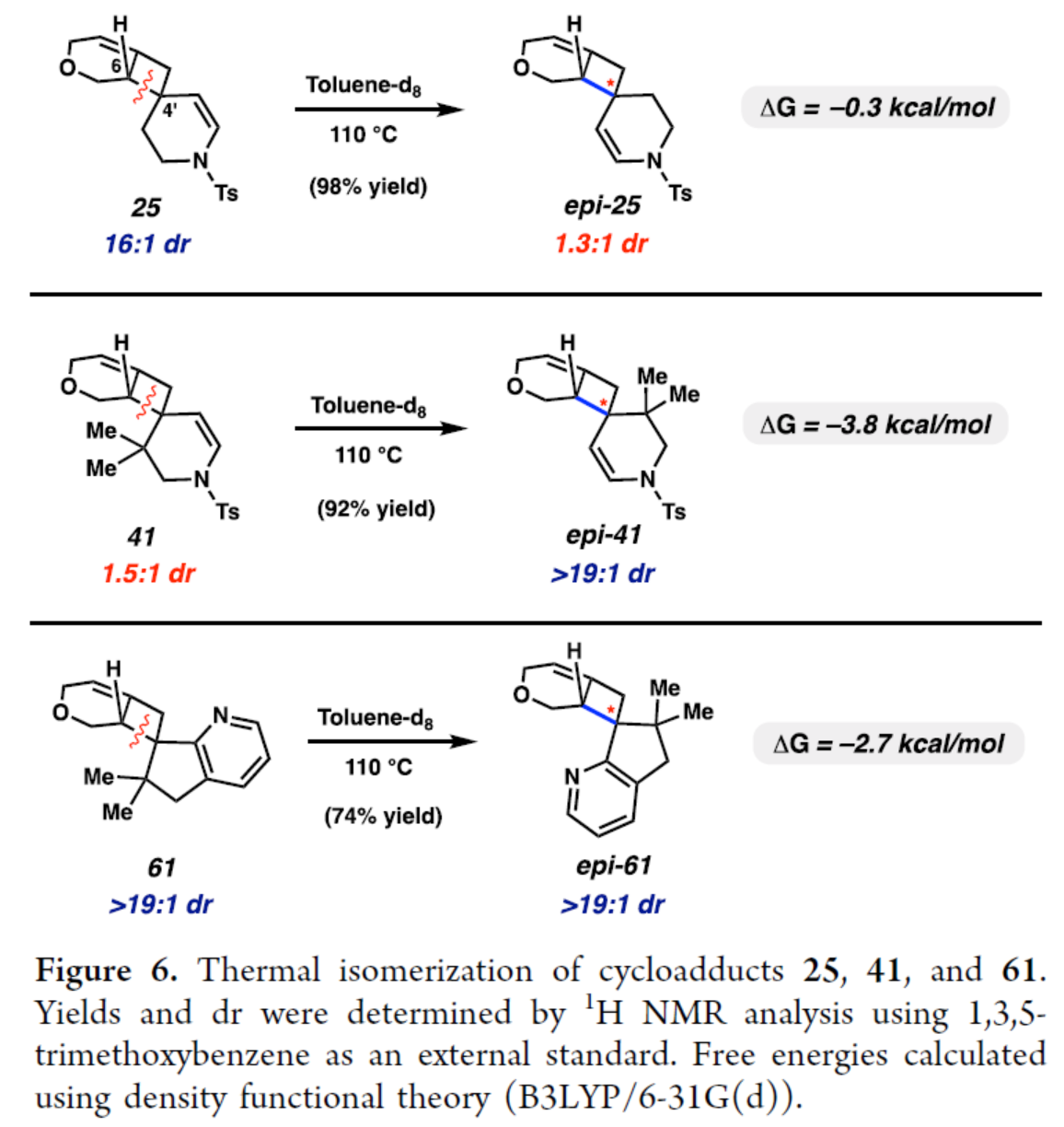
(图片来源:J. Am. Chem. Soc.)
最后,作者对反应的实用性进行了研究(Figure 7)。首先,化合物68与38在上述标准条件下反应,可以82%的收率得到环加合物70,dr>19:1。化合物70在DBU/MeNO2条件下反应,可以52%的收率得到具有四个连续手性中心的化合物71,dr>19:1。化合物70可与硼试剂72在Pd(PPh3)2Cl2/K2CO3条件下进行偶联反应,可以32%的收率得到化合物73。其次,化合物74与76在上述标准条件下反应,可以43%的收率得到环加合物77。化合物77在m-CPBA条件下进行环氧化反应,可以47%的收率得到具有四个小环与三个连续手性中心的化合物78,dr>19:1。此外,化合物12与79在上述标准条件下反应,可以84%的收率得到环加合物80,dr为13:1。化合物80与肟化合物81在NaHCO3/EtOAc条件下进行(3+2)环加成反应,可以33%的收率得到具有五个连续手性中心的化合物82,dr>19:1。
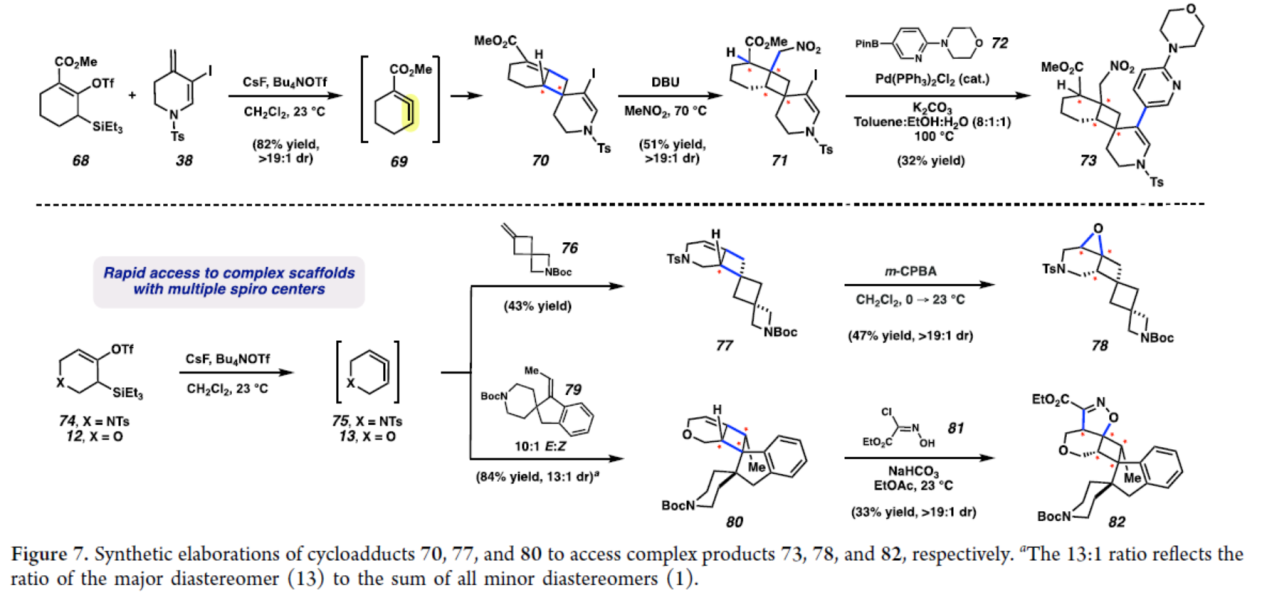
(图片来源:J. Am. Chem. Soc.)
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn