

引言
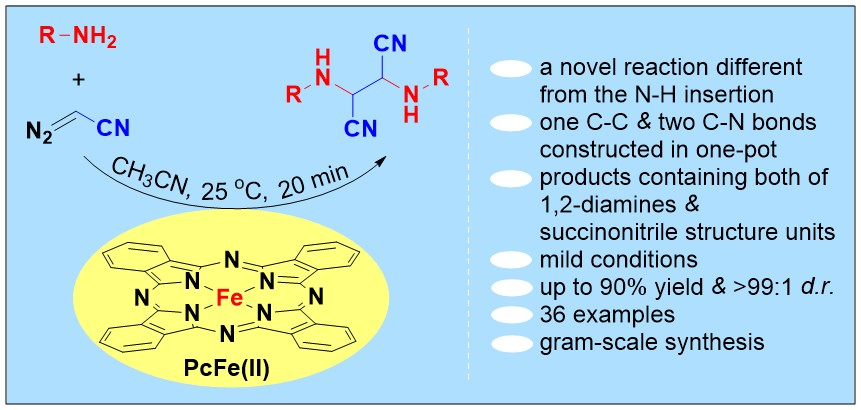
重氮化合物因其高反应活性而成为有机合成中具有重要应用价值的合成砌块,金属催化重氮试剂多种多样的转化已成为制备许多高附价值分子的有力工具。在其诸多转化中,金属催化重氮化合物与胺之间的N-H键插入反应是构建碳氮键最直接的手段之一,反应机理一般认为是胺进攻由金属与重氮试剂生成的金属卡宾、随后发生质子转移,得到N-H键插入产物(图1)。然而,据目前所知,金属催化胺与重氮化合物之间的反应主要集中在或仅限于N-H键插入反应。化学加——科学家创业合伙人,欢迎下载化学加APP关注。
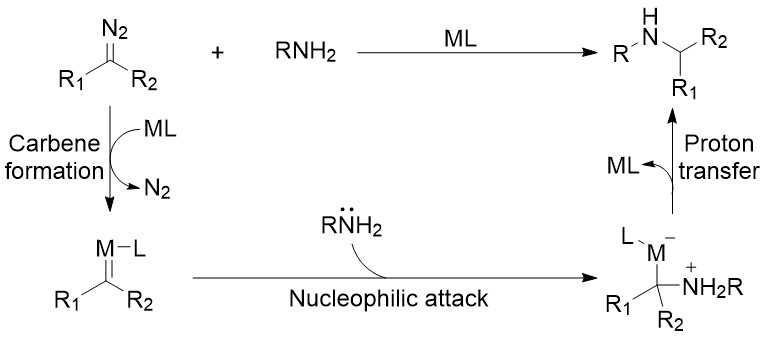
图1 金属催化胺与重氮试剂的N-H键插入反应
基于传统的经典反应和合理的设计,寻求新的突破及发展新的转化反应总是令人心生向往和着迷的。在有关重氮试剂的转化反应中,金属自由基催化提供了一种概念上的新方法,它利用金属自由基配合物作为一种新的催化剂,以生成的金属有机自由基作为关键中间体来调节后续的自由基反应(以金属卟啉为例,其金属自由基催化过程如图2所示)。在其反应机理中,重氮试剂与金属卟啉反应生成的金属卡宾自由基,通过自身与其它底物的自由基或离子反应途径,有效地促进了后续反应的进行,最终得到目标化合物。
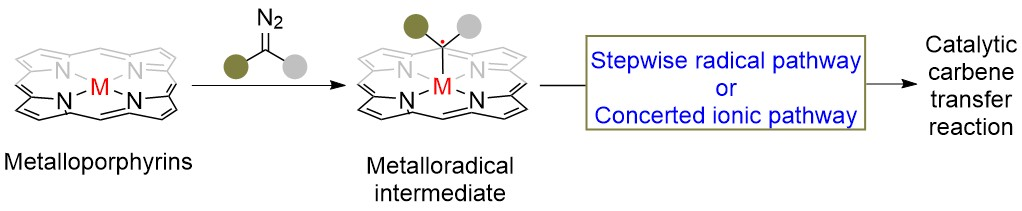
图2 金属卟啉催化的金属自由基催化过程
受到金属自由基催化机理的启发以及基于金属催化重氮试剂与胺的N-H键插入反应中涉及到了金属卡宾中间体,作者设想金属I与重氮试剂相互作用生成的金属卡宾Ⅱ可形成其共振结构Ⅲ(即金属卡宾自由基),然后III自偶联成二聚体IV,随后体系中存在的胺亲核进攻碳-金属键上的碳原子,同时碳-金属键发生均裂,最后释放出氢气得到1,2-二胺类化合物V(图3)。
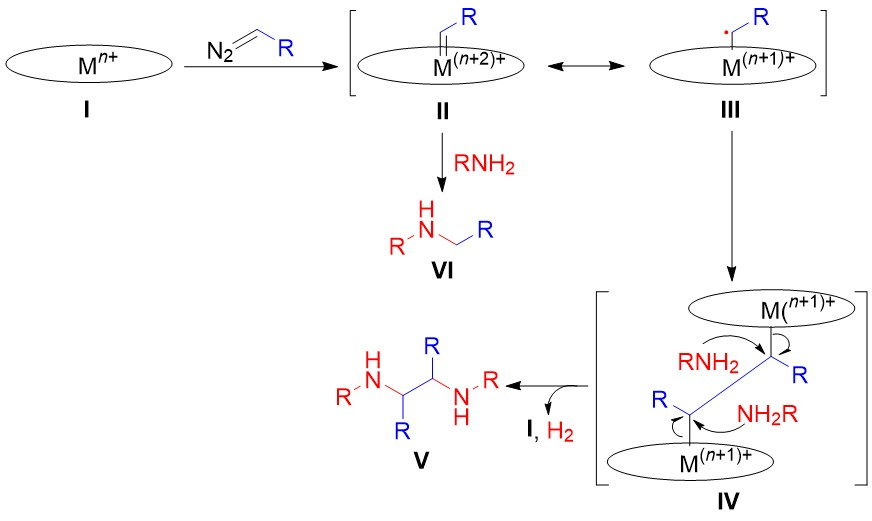
图3 金属催化重氮试剂与胺反应的设想
2011年,Zhang课题组由四苯基卟啉钴(II)与苯乙烯重氮乙酸乙酯成功制备并分离得到了一个双核钴(III)卟啉配合物,显然它是由生成的钴(III)乙烯卡宾自由基(α-自由基)通过其共振结构—γ-自由基烯丙基—二聚产生的(图4)。这为金属自由基催化循环中存在金属卡宾自由基提供了强有力的实验证据;同时,这一事实也表明,在一定条件下,金属卡宾的共振结构可以通过自身二聚化产生其二聚体IV(图3),但它可能需要有某种因素稳定下来才能实现。显然,这个实验证据也说明上述假设是合理的,在一定条件下,金属催化重氮试剂与胺的反应是可以进行自二聚-串联二胺化反应的,并生成1,2-二胺类化合物。
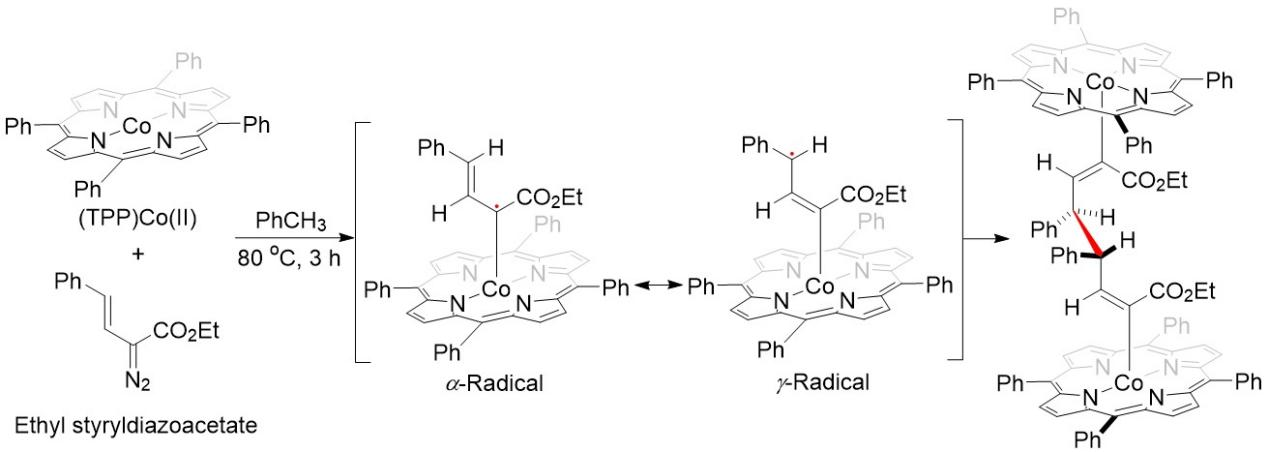
图4 由四苯基卟啉钴(II)与苯乙烯重氮乙酸乙酯反应得到的双核钴(III)卟啉配合物
结果与讨论
为了初步探讨该反应的可行性,作者以一个当量(0.5 mmol)苯胺和两个当量的重氮乙腈作为模型反应底物,酞菁铁(II)(PcFe(II),1 mmol%)作为催化剂,二氯甲烷作为溶剂,在25 ℃下反应20 min,能以82% 的产率、d.r.值2.5:1得到了目标产物2,3-二(苯胺基)琥珀腈(2a,表1,entry 1)。当PcFe(II)被酞菁氯化铁(III)(PcFe(III)Cl)取代时,产率降至76% (entry 2);四苯基卟啉氯化铁((TPP)Fe(III)Cl)、四苯基卟啉钴(II)((TPP)Co(II))和酞菁钴(II)(PcCo(II))均没有得到该产物(entries 3-5),以及其他常用的无机试剂,如FeCl2、FeSO4和CuI等,也没有得到目标产物(entries 6-9)。因此,PcFe(II)在上述条件下表现出最高的催化活性。因此,选择PcFe(II)作为催化剂,在0 ℃和40 ℃ (entries 10-11)条件下进行反应,产率分别为76%和82%,d.r.值分别为2.5:1和2.9:1。显然,25 ℃为最佳反应温度。另外,还选择了四氢呋喃(THF)、甲苯、甲醇、乙醇和乙腈作为反应溶剂(entries 12-16),结果表明THF和甲苯不适合,而甲醇、乙醇和乙腈等都有利于该反应。由于乙腈作溶剂时,2a的产率最高可达90%和2.9:1 d.r.(entry 16),因此,将乙腈作为溶剂。没有PcFe(II),反应则不能进行,这表明PcFe(II)对于该转化是至关重要的(entry 17)。基于这些结果,获到了最优反应条件(表1,entry16)。
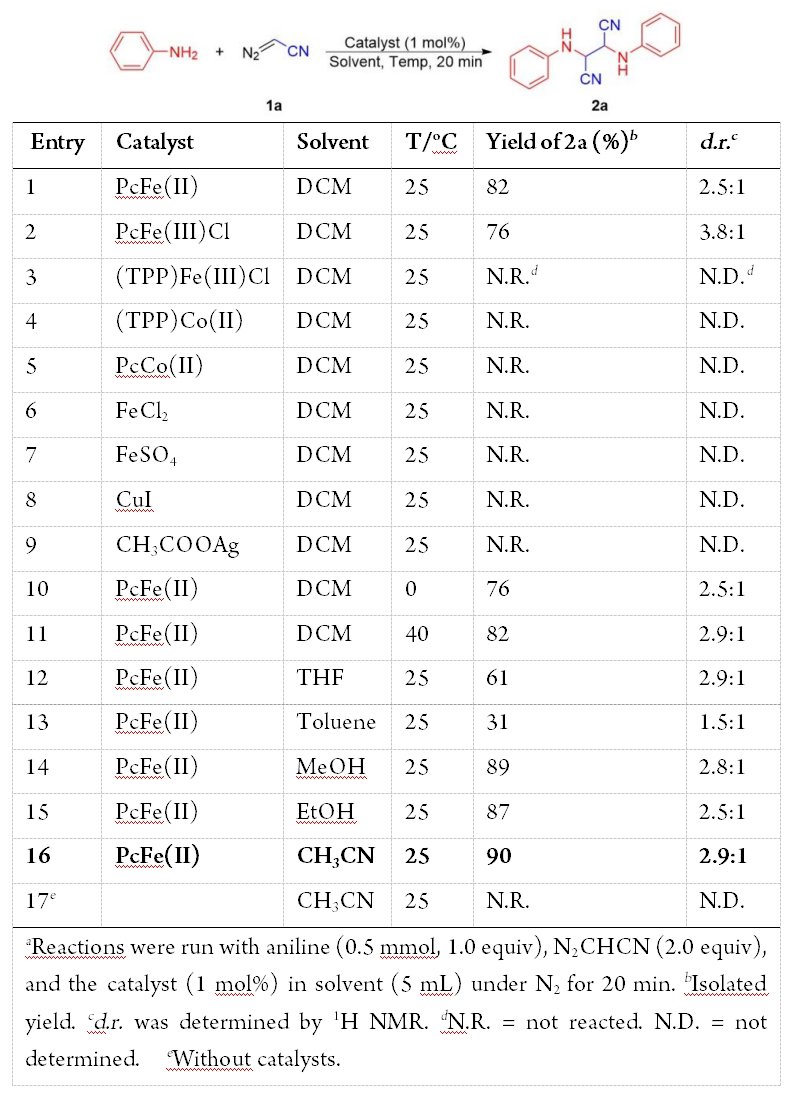
表1 反应条件的优化
在最佳反应条件下,作者考察了该反应的底物普适性,结果如图5所示。大多数带有给电子和吸电子基团的芳胺都适合于这种转化,以中等至优秀的产率(60%-90%)得到了目标化合物(2a-2x)。除硝基外,芳胺苯环的对位上带吸电子或供电子基团均有利于该反应。邻位带有取代基的芳胺只是稍微降低了目标产物的产率,但明显地提高了它们的d.r.值(2m-2p)。间位取代基以高达89%和90%的产率得到了目标产物(2q,2r),空间位阻大的2,4-二溴苯胺、2,6-二甲基苯胺和2,4,6-三甲基苯胺的目标产物产率可达60%以上(2u-2w),且具有很高的d.r.值。其中2,4-二溴苯胺与2,4,6-三甲基苯胺由于空间位阻效应较大,其d.r.值大于99:1(2u,2w),X射线晶体衍射清楚地确定了2v的绝对构型。多环1-萘胺以高产率(83%)得到了目标产物(2x)。但是,杂芳环胺2-氨基吡啶和2-氨基噻吩(2y,2z)在该催化体系下没有得到目标化合物。脂肪胺表现出良好的反应活性。例如,苄胺和环己胺以较高的产率(80%,2aa;83%,2ab)形成了预期的产物;更令人兴奋的是,长链的己胺和庚胺也得到了目标产物,收率分别为59%和55%,d.r.值均大于99:1(2ac,2ad) 。此外,芳香杂环2-噻吩乙胺和2-呋喃乙胺同样适合该催化体系,产率分别为84%和78%(2ae,2af)。这些结果表明,具有更大空间位阻的芳胺和长链脂肪胺有利于提高它们的d.r.值。不过,苯甲酰胺不适用于这个反应。
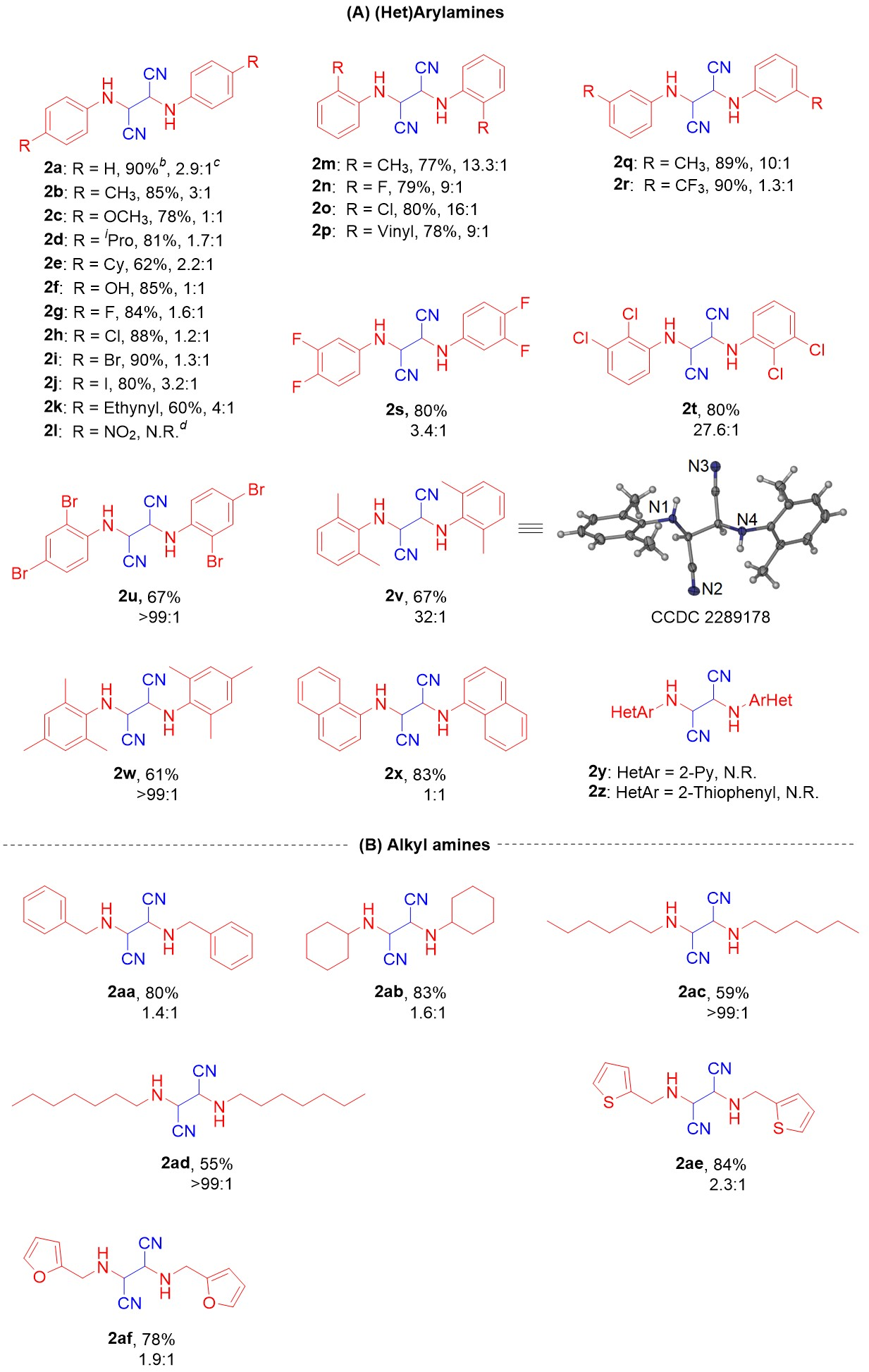
图5 伯胺类化合物的普适性
此外,作者也对重氮试剂的普适性进行了研究,分别尝试了重氮乙酸乙酯(1b)、重氮乙酰乙酸乙酯(1c)、(三甲基硅基)重氮甲烷(1d)和二苯甲基重氮甲烷(1e)与苯胺的反应,然而只有1b可以83%的产率得到其1,2-二酯取代的1,2-二胺(2ae)(图6)。
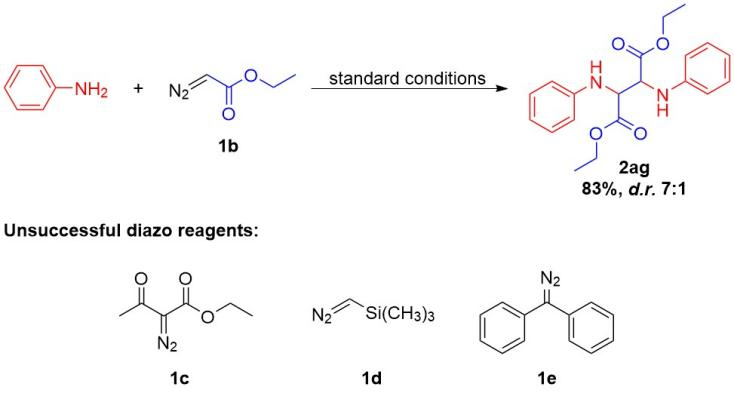
图6 重氮化合物的普适性
作者还尝试了该反应的应用潜力,对其进行了放大实验。即在最优反应条件下对模型反应进行了克级规模试验,结果能以84%的高产率得到了2a(2.2 g,图7),展示了该反应可用于工业生产的潜力和价值。
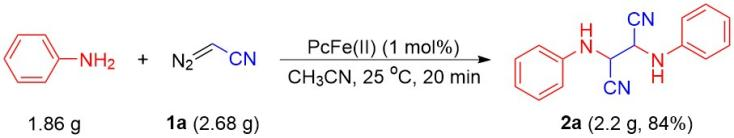
图7 放大实验研究
为了理解反应可能的机理,作者对其进行了探讨。在自由基抑制剂2,2,6,6-四甲基哌啶-1-氧基(TEMPO)存在下,没有得到目标产物2a(图8(a)),表明该反应涉及到了自由基。
重氮试剂在Cu、Co、Rh、Ag、Au等催化剂作用下可以二聚生成烯烃化产物。然而,对于发展的反应,作者没有检测到烯烃的二聚化产物—丁烯二腈(1f,图8(b),Eq. 2)生成。即便如此,作者仍然研究了苯胺与1f在标准条件下的反应,但没有得到2a,表明1f不是该反应的关键中间体。在表1、 entry 16所示的反应中,检测到了痕量的N-H键插入产物—2-(苯基氨基)乙腈(2ah, 图8(b),Eq. 3),表明苯胺对铁(IV)卡宾PcFeIV=CHCN的插入反应是一个次要途径或副反应。作者进一步研究了PcFe(II)与2ah之间的反应,没有得到产物2a,证明2ah也不是反应的中间体。
以N-甲基苯胺或4-甲基苯硫酚代替苯胺的反应也不能得到它们相应的产物2ai和2aj(图8(c),Eq. 4、5),表明作为一级胺的苯胺在碳碳键的形成过程中起着极其重要的作用。
4-硝基苯胺在标准条件下与1a反应,由于硝基的强吸电子效应,没有生成目标产物2l(图5),然而,令人兴奋的是,它生成了意想不到的产物—2-(4-硝基苯基)琥珀腈(2ak),产率达到73%(图8(d))。观察发现2ak的分子结构中琥珀腈骨架仍然存在,这表明碳碳键的形成是通过铁(Ⅲ)-卡宾自由基的自身偶联形成的,且先于碳氮键的形成。
为了检测有H2生成,作者以亚甲蓝铂溶液作为检测试剂,从反应开始到反应结束监测其紫外-可见光谱变化(图8(e)),发现图中663 nm处的吸收峰明显下降,即从0.24下降至0.16,说明的确有H2生成。
基于上述控制实验和文献关于胺对PcFe(II)的配位作用,该反应可能的机理如图8(f)所示。在伯胺的存在下,PcFe(II)首先形成双(胺)络合物(A),然后胺配体的离解产生五配位酞菁铁物种,其具有足够的电子密度和开放的配位位点,使其可以和1a生成铁(IV)卡宾PcFeIV=CHCN(B)及其共振结构α-铁(III)-烷基自由基PcFeIII-CHCN(C)。C经过自身二聚形成二聚体(D),即碳碳键生成了。然后,D通过β-氢消除和一个碳-铁(III)键的断裂转化为酞菁铁(III)-氢(PcFeIII-H)和中间体E。接着,一个胺分子亲核进攻E中双键的末端碳原子,生成F,然后通过质子转移生成G,G又经历β-氢消除和另一个碳-铁(III)键的断裂得到H,H再与另一分子胺反应生成目标产物。在这个过程中,两个PcFe III-H分子之间的相互作用释放出了氢气和PcFe(II)(path a)。
此外,另一个反应途径也不能完全排除(path b)。铁(IV)卡宾B与胺反应生成铁(II)物种(I),其中碳-铁(II)键的均裂产生酞菁铁(I)、质子和自由基(J),然后自由基J自身偶联形成目标产物。质子被被酞菁铁(I)还原或捕获生成了H2。
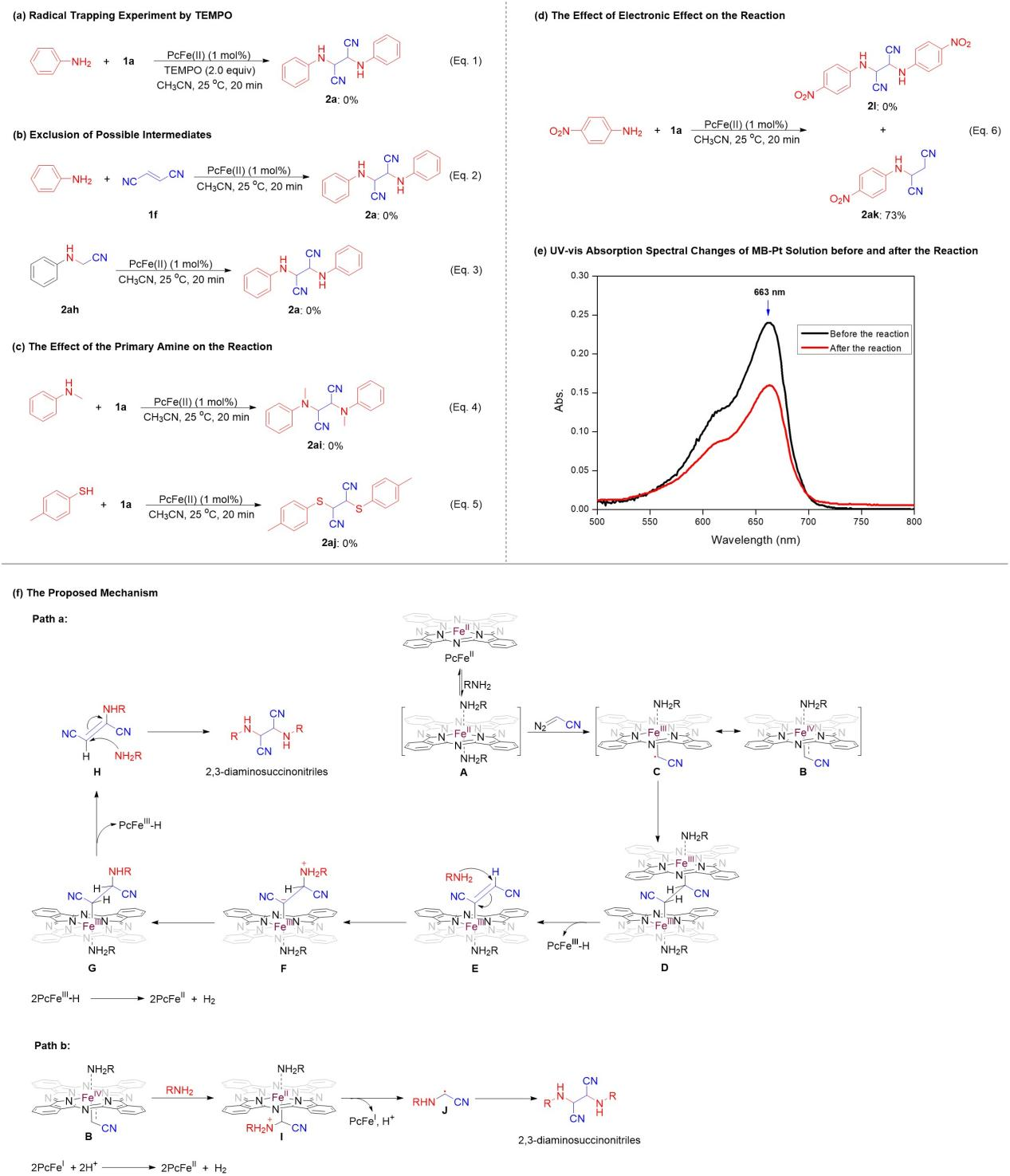
图8 可能的机理
总结
宜春学院邹怀波课题组发展了酞菁铁(II)催化重氮乙腈与伯胺之间进行的自二聚-串联二胺化反应,它与传统意义上重氮试剂与胺之间发生的N-H插入反应是完全不同的,是一类全新的反应,它拓展了人们对金属催化下重氮试剂与胺之间可能只发生N-H键插入反应的认知范围。邹怀波副教授为该论文的通讯作者,宜春学院2021级药学专业硕士研究生王刚、2021级化学师范专业本科生袁嘉丽分别为该论文的第一、第二作者。北京大学王剑波教授在机理讨论方面给予了十分宝贵的建议和帮助,在此表示感谢!
导师简介

邹怀波,湖北黄冈人,宜春学院化学与生物工程学院副教授,硕士生导师。2003年6月本科毕业于长江大学,获得应用化学理学学士学位,导师为李水清教授;同年9月考入西南大学,师从丁伟教授从事农药学方向的研究,于2006年7月获得农学硕士学位;2012年9月考入华南理工大学,师从刘海洋教授从事金属咔咯大环配合物的制备及其催化活性研究,于2015年9月获得无机化学理学博士学位。2017年8月至2019年8月,在韩国首尔梨花女子大学(梨大)做博士后研究,从事金属-氧活性中间体的制备及其氧原子转移方向的研究,导师为韩国科学院院士、梨大杰出教授Wonwoo Nam和梨大特聘教授、日本大阪大学杰出教授Shunichi Fukuzumi。2016年获得国家留学基金委(CSC)出国留学奖学金,2021年获得宜春学院“优秀教师”荣誉称号。目前,主要从事重氮试剂在有机合成中的转化及其应用方向的研究。前期的学术成果以第一作者(含共同第一作者)、通讯作者发表在 J. Am. Chem. Soc.、J. Org. Chem.、Organometallics、ACS Omega、化学进展等国内外重要化学期刊上。课题组主页https://www.x-mol.com/groups/hbzou
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn