

(图片来源:J. Am. Chem. Soc.)
正文
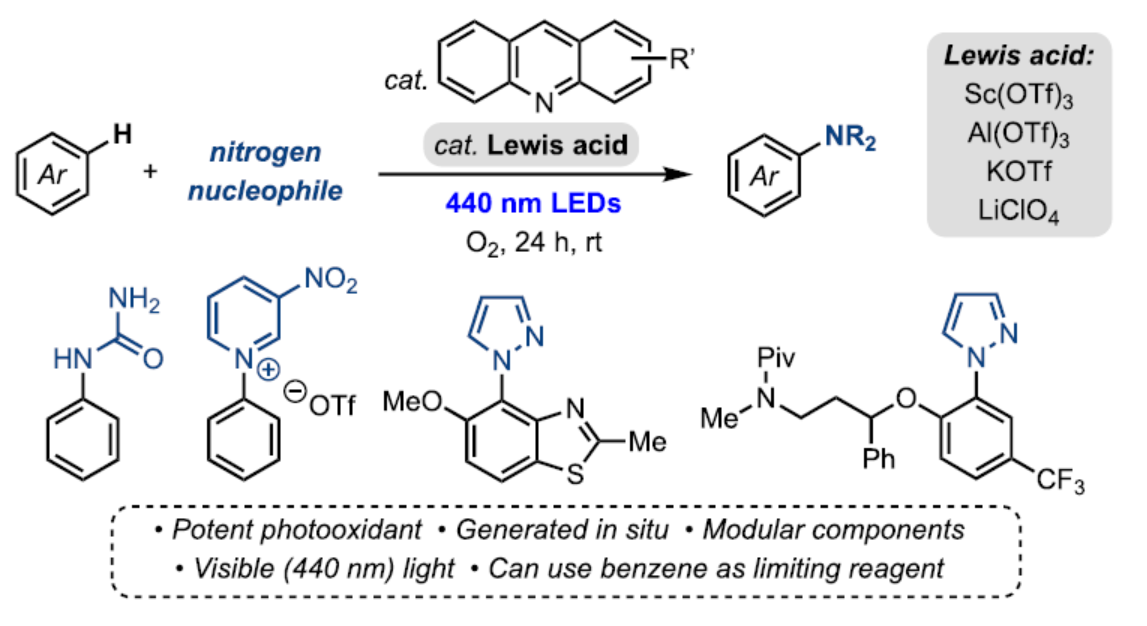
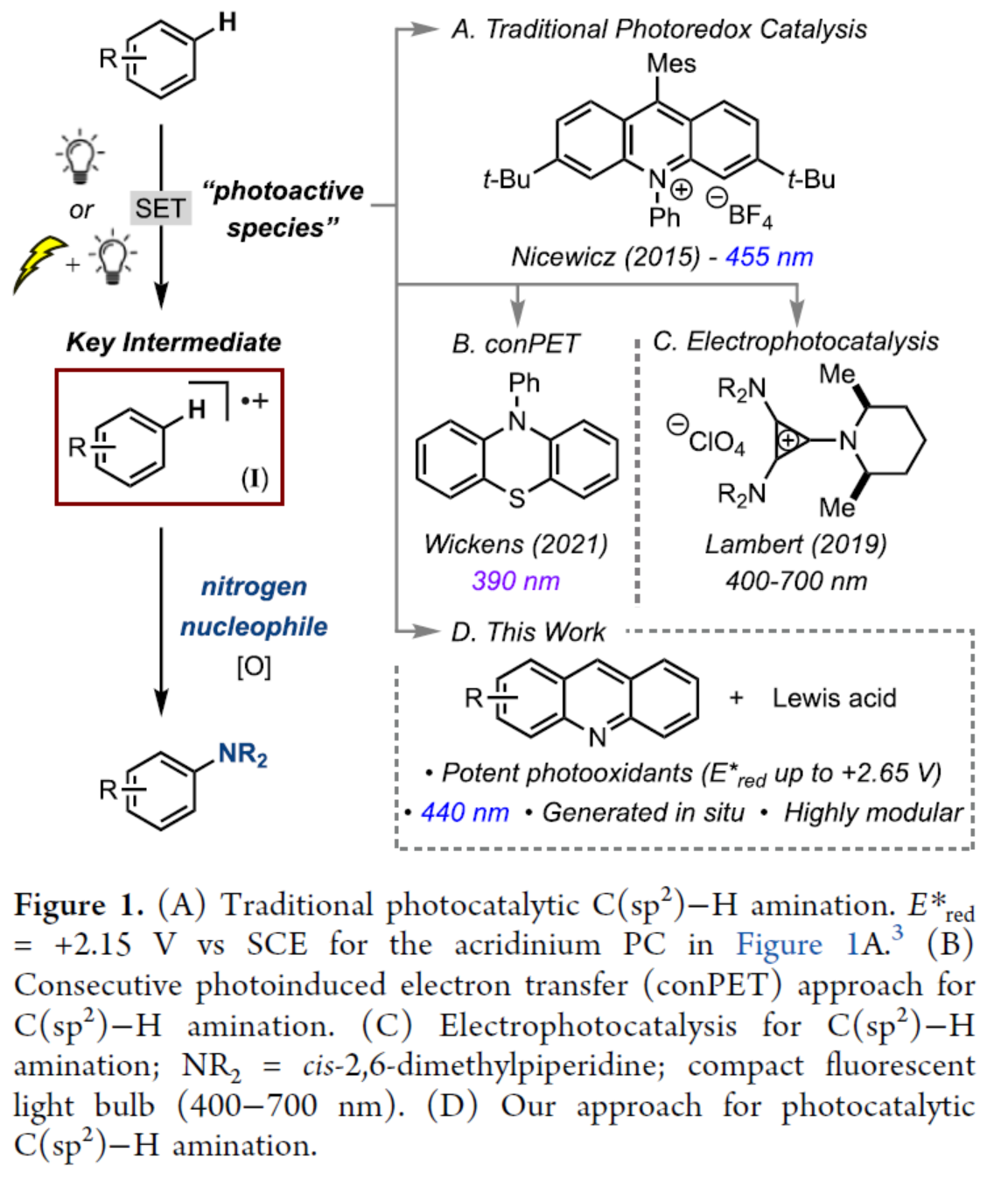
在过去的十年里,光氧化还原催化已成为使用各种光催化剂(PC)和氮亲核试剂对芳香族底物进行C−H胺化的一种强大方法(Figure 1A)。通常,此类反应通过一种机理进行,涉及(i)PC的激发生成PC*;(ii)PC*和芳烃底物之间的单电子转移(SET)生成芳基自由基阳离子I;(iii)氮亲核试剂捕获I以及(iv)氧化形成芳基胺产物。然而,此类方法存在一定的局限性,如PC的合成常使用昂贵的试剂或者多步合成、底物仅限于富电子芳烃等。最近,化学家们一直致力于活性较低芳烃(如甲苯和苯)的胺化反应研究。通过使用吸收可见光的基态氧化剂或通过利用替代途径实现,如连续光诱导电子转移(conPET)(Figure 1B)或电光催化(Figure 1C)。然而,现有的方法仍然需要预组装催化剂,并且它们通常需要大量过量的芳烃底物来提供合成有用的收率。近日,美国密歇根大学Melanie S. Sanford课题组报道了一种互补的方法,该方法利用原位生成的PCs来实现可见光光催化C(sp2)−H胺化反应(Figure 1D)。这些催化剂可以在C−H胺化反应条件下,通过简单地将Lewis酸(如Sc(OTf)3或Al(OTf)3)和吖啶衍生物组合来组装。化学加——科学家创业合伙人,欢迎下载化学加APP关注。
(图片来源:J. Am. Chem. Soc.)
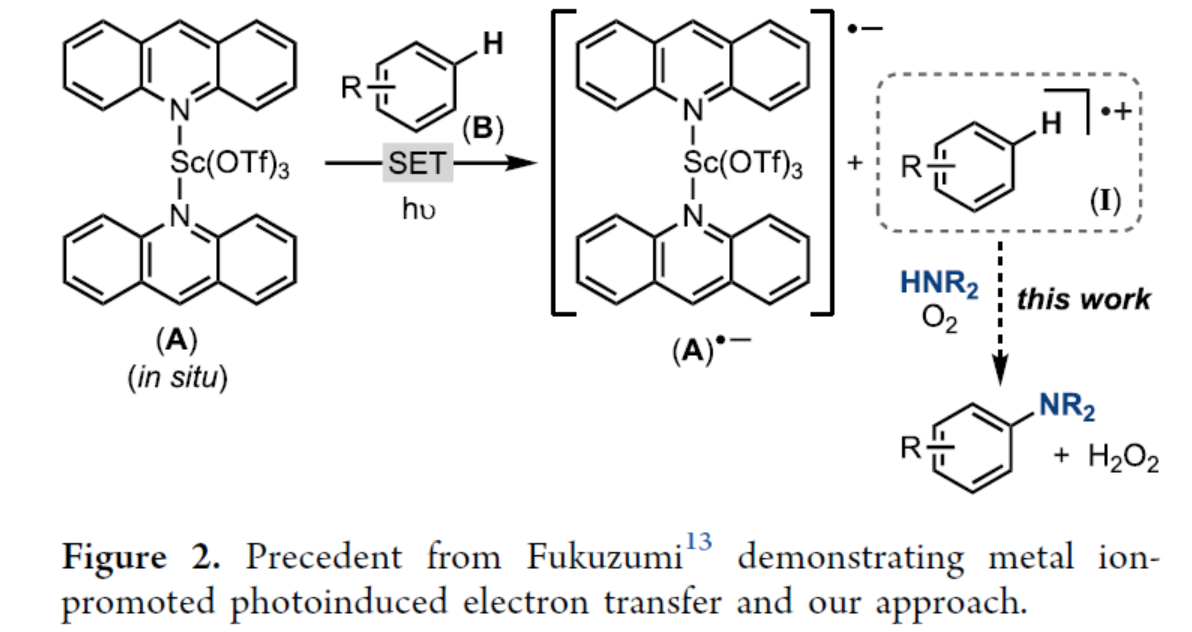
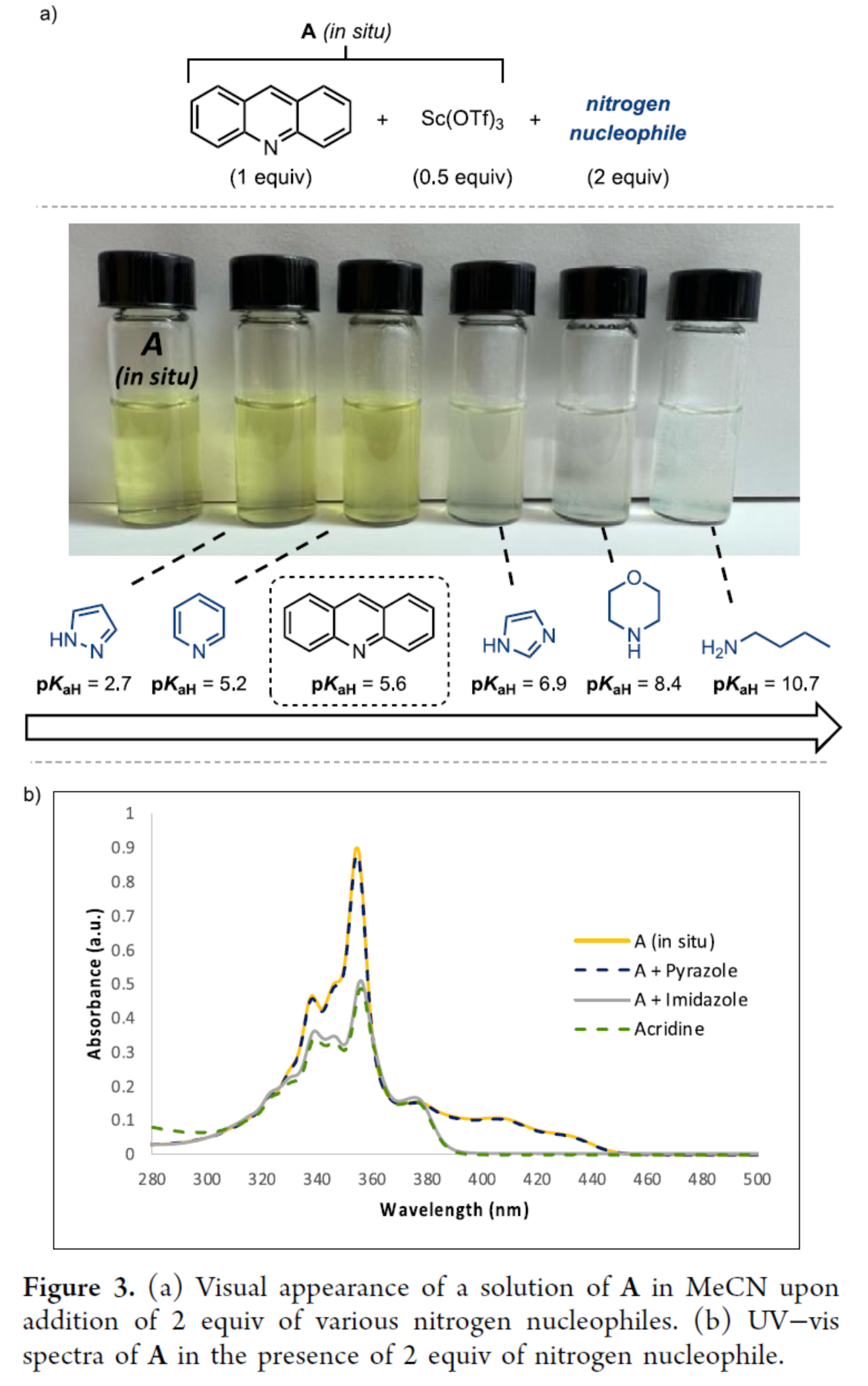
2004年,Fukuzumi课题组(J. Am. Chem. Soc. 2004, 126, 7585.)报道了一种在Sc(OTf)3存在下吖啶的光诱导电子转移反应。该研究结果表明,加入0.5当量的Sc(OTf)3会产生具有单线态激发态的2:1配合物(A),该配合物A可被二甲苯、甲苯和苯淬灭(Figure 2)。Melanie S. Sanford课题组认为,吖啶和Sc(OTf)3的组合可以作为芳烃进行C−H胺化的有效PC,涉及形成芳基阳离子中间体I的过程。然而,该体系也存在一个关键性的挑战,即Lewis碱性胺亲核试剂也可以与Sc(OTf)3竞争性结合,从而破坏PC A的原位形成。因此,作者在加入2当量的各种氮亲核试剂后,对A在MeCN中的溶液外观进行了比较(Figure 3a)。其中,对于pKaH低于吖啶的亲核试剂(如吡唑、三唑和吡啶衍生物),颜色未发生变化。对于pKaH高于吖啶的亲核试剂(如咪唑、1或2°胺),颜色褪去。其次,通过A在2当量氮亲核试剂存在下的紫外-可见光谱的研究结果,进一步为选择有效的氮亲核试剂进行A催化的C−H胺化提供了指导(Figure 3b)。
(图片来源:J. Am. Chem. Soc.)
(图片来源:J. Am. Chem. Soc.)
其次,作者以联苯与吡唑(5.0 equiv)作为模型底物,进行了相关反应条件的筛选(Table 1)。当以吖啶(10 mol %)作为催化剂,Sc(OTf)3(5 mol %)作为Lewis酸,440 nm Kessil LEDs作为光源,在DCE溶剂中氧气氛围下室温反应24 h,可以97%的收率得到产物1。
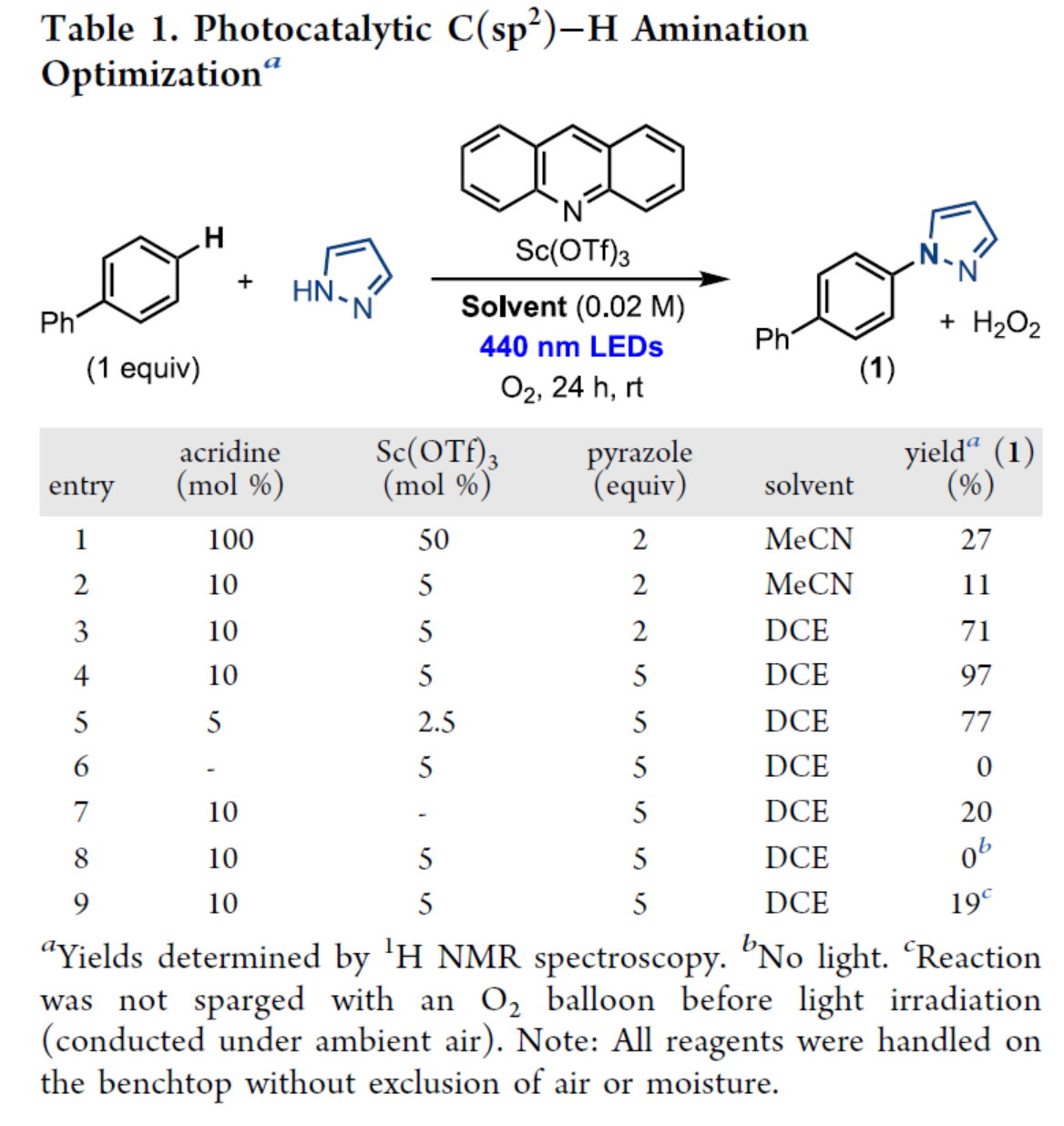
(图片来源:J. Am. Chem. Soc.)
在获得上述最佳反应条件后,作者对氮亲核试剂底物范围进行了扩展(Scheme 1)。吡唑、三唑和吡啶衍生物,均可顺利反应,获得相应的产物1-10,收率为39-87%,区域选择性为2:1->20:1。然而,咪唑(IM)未能有效的进行反应。
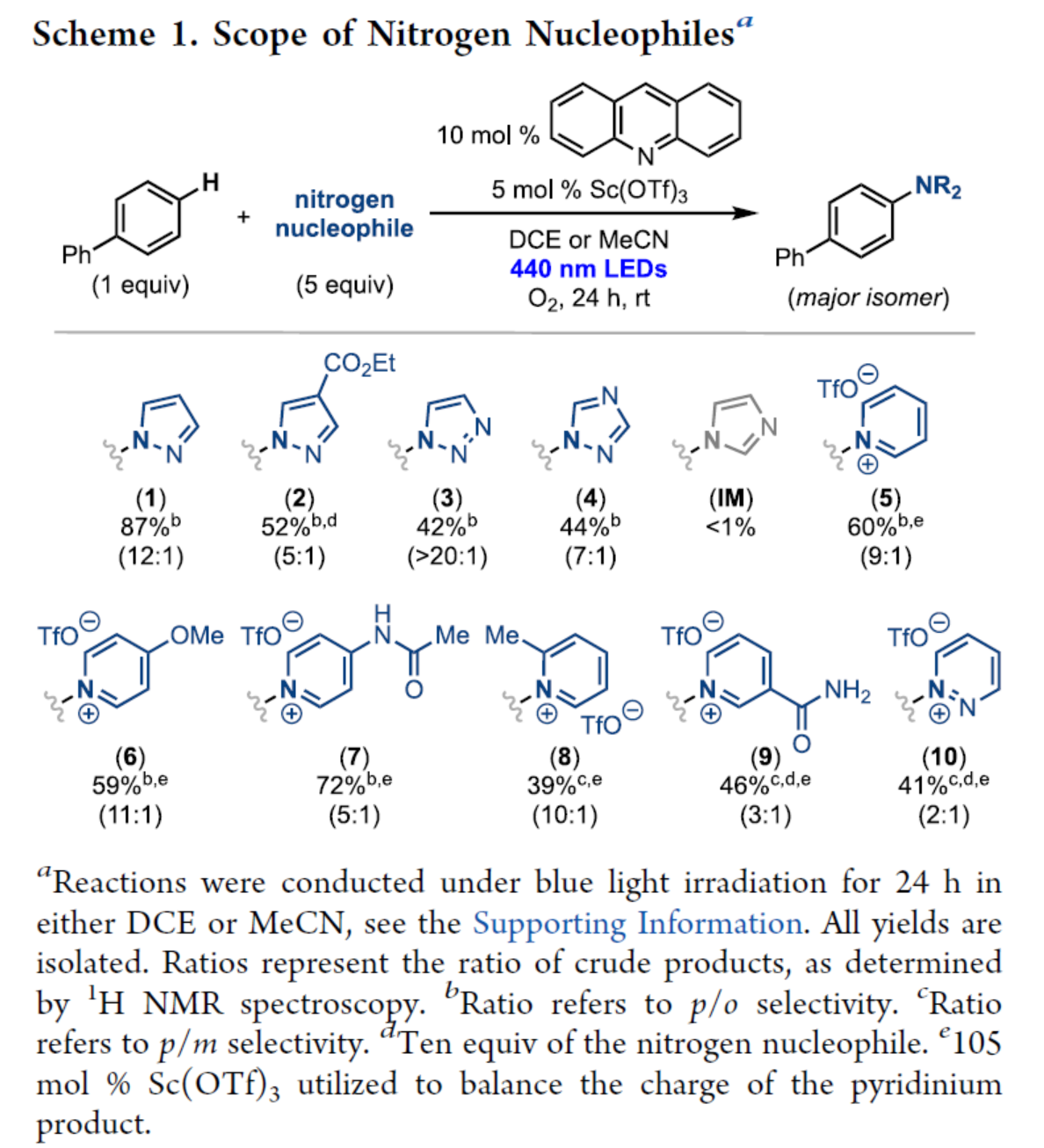
(图片来源:J. Am. Chem. Soc.)
紧接着,作者对芳烃的底物范围进行了扩展(Scheme 2)。富电子(杂)芳烃,均可顺利反应,获得相应的产物11-16,收率为51-82%。其中,产物11和12的
区域选择性分别为4.5:1和7:1。一系列烷基取代的芳烃(17−20)与含有吸电子基的苯甲醚衍生物(23−25),可以52-82%的收率得到相应的产物。含有酰胺(21)、三氟甲磺酸酯(22)、乙酸酯(26)、内酯(27)和质子化胺(31)官能团的底物,均与体系兼容,收率为35-83%。同时,该策略还可用于一些生物活性分子的后期修饰,获得相应的产物28-31,收率为31-67%。
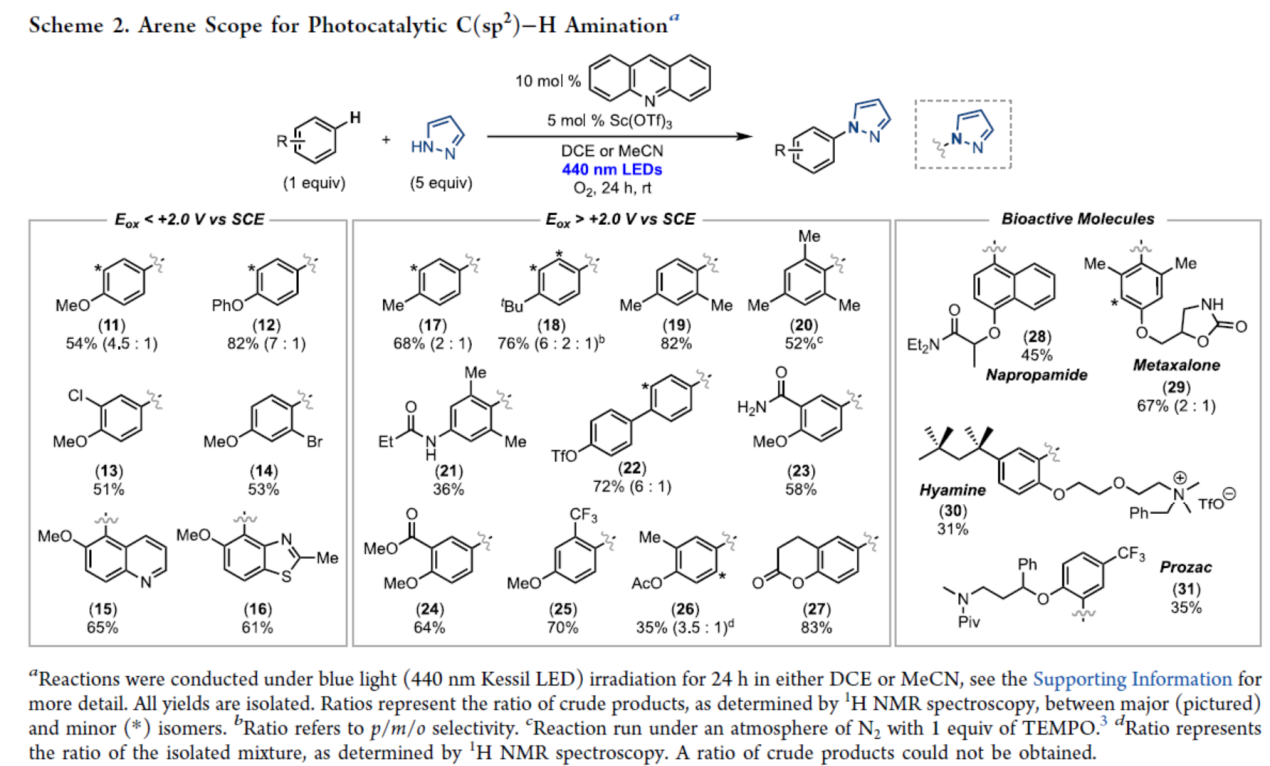
(图片来源:J. Am. Chem. Soc.)
同时,作者将氮亲核试剂用量降低至1当量,并使用过量的芳烃,对反应进行了研究(Scheme 3)。含有各种吸电子基团的吡唑衍生物及其无取代的吡唑,均可顺利反应,获得相应的产物32-39,收率为31-80%。尿素和氨基甲酸叔丁酯,也是有效的亲核试剂,可分别以41%和31%的收率得到相应的产物40和41。3-硝基吡啶也以56%的收率得到相应的产物42。其次,含有吸电子氯、溴和三氟甲氧基取代基的芳烃,也可与4-氰基吡唑顺利反应,获得相应的产物43-47,收率为53-62%。
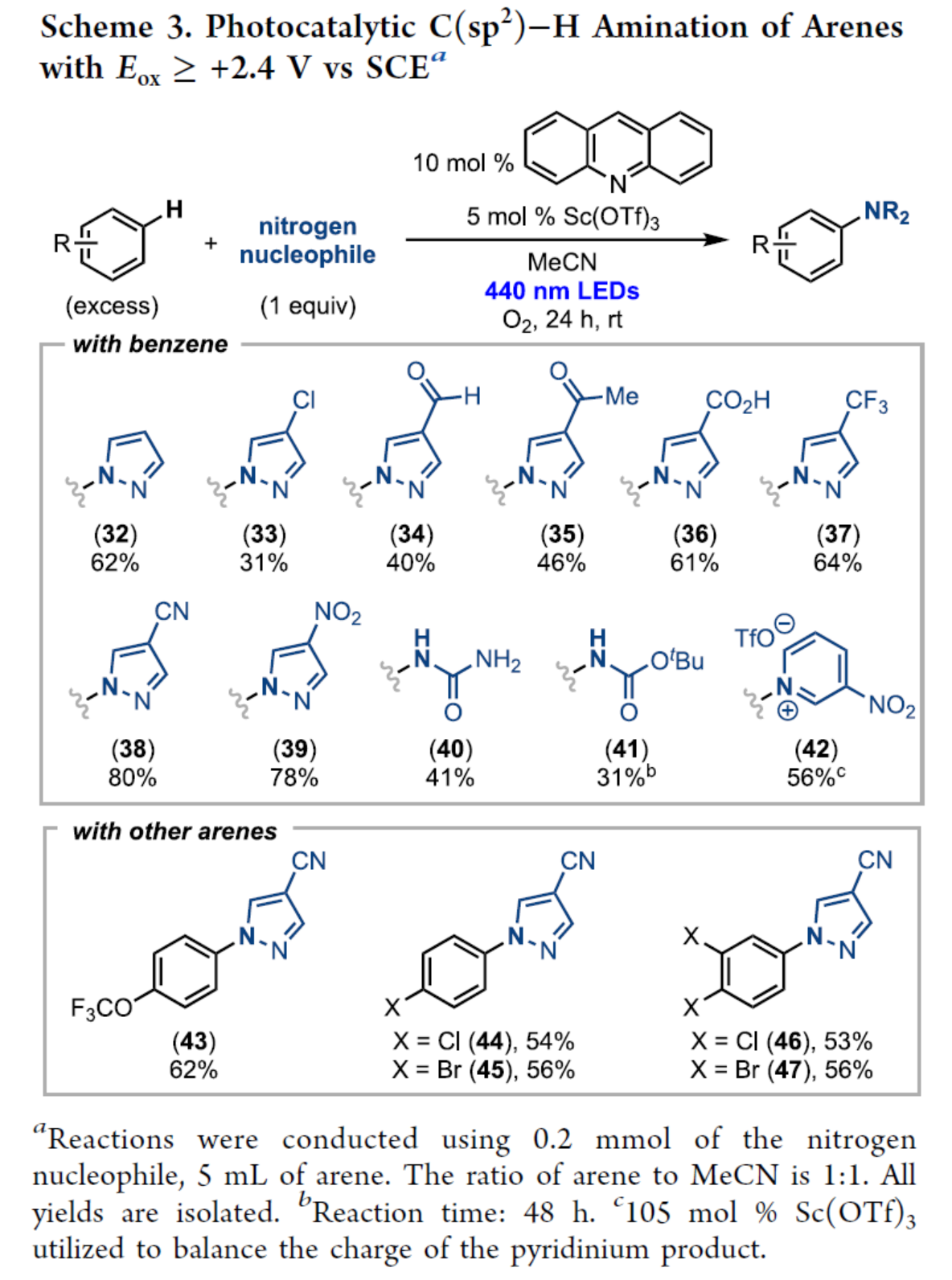
(图片来源:J. Am. Chem. Soc.)
随后,作者对不同Lewis酸和吖啶衍生物对苯C−H胺化反应进行了筛选(Scheme 4)。首先,利用不同的Lewis酸和吖啶衍生物,对苯(过量)与三种氮亲核试剂(1H-吡唑-4-碳腈、氨基甲酸叔丁酯和3-硝基吡啶)的光催化反应研究结果表明,(1)在改变Lewis酸、吖啶和胺亲核试剂时,收率变化很大,突出了组合筛选方法的价值;(2)衍生自Sc(OTf)3、Al(OTf)3和 Zn(OTf)2的基于Acr的PCs,获得与所有三种亲核试剂相当的收率;(3)Acr-Cl和Acr-Py+的收率与使用1H-吡唑-4-碳腈和3-硝基吡啶的Acr的收率相似,但使用氨基甲酸叔丁酯的收率明显较低。其次,通过三种不同的Lewis酸(Sc(OTf)3、Al(OTf)3和 Zn(OTf)2)和吖啶衍生物(Acr、Acr-Cl和 Acr-Py+)对3-硝基吡啶(5.0 equiv)与苯(1.0 equiv)的胺化反应研究表明,第一代Acr/Sc(OTf)3催化剂,以较低的收率(4%)获得产物42。然而,当改变Lewis酸(Al(OTf)3)或吖啶配体(Acr-Py+)时,收率增加到55%(Scheme 4B)。
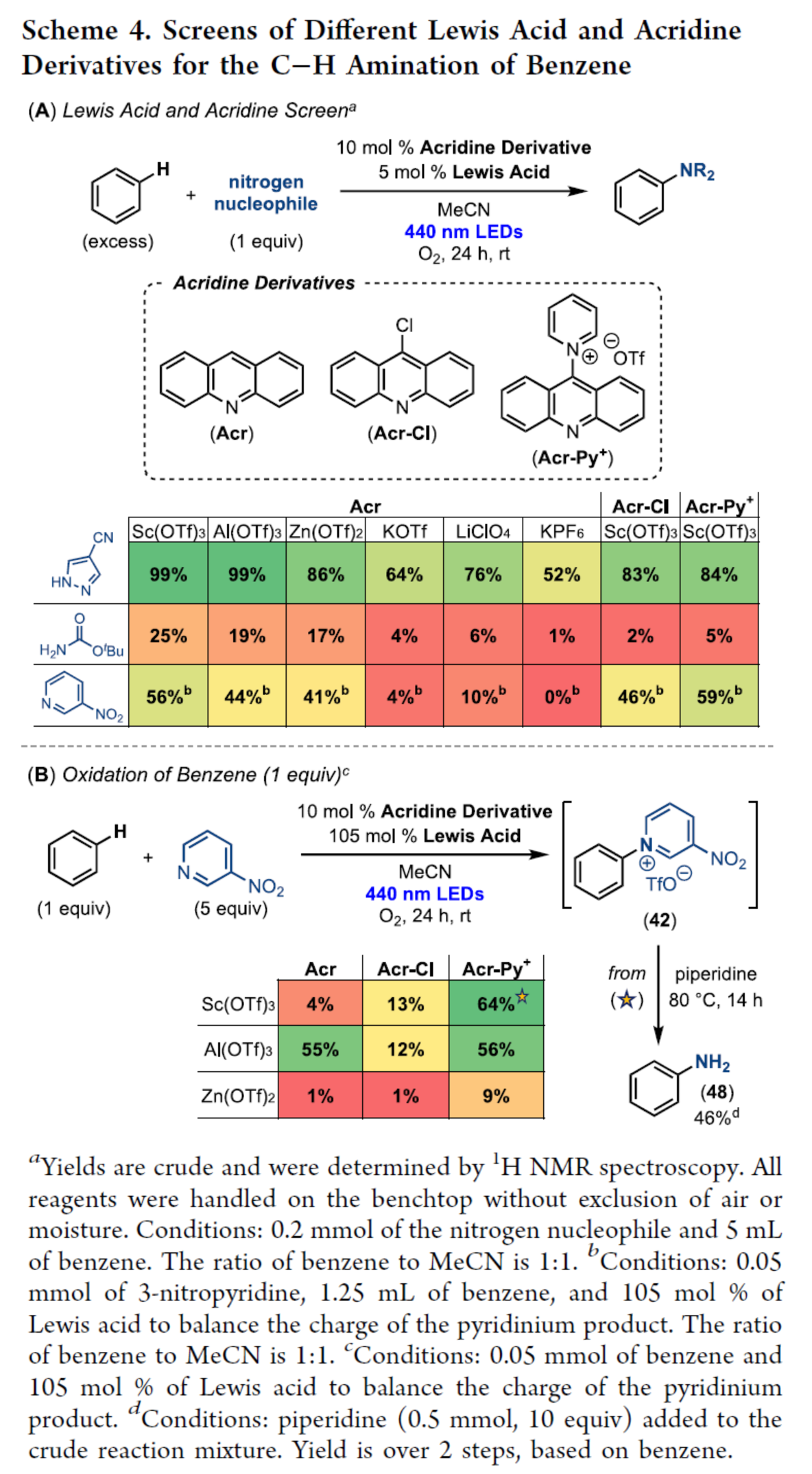
(图片来源:J. Am. Chem. Soc.)
最后,通过原位PCs(A−C)的实验测定E*red结果表明,缺电子吖啶导致原位PCs比A更具氧化性(Figure 4)。然而,有趣的是,催化剂B的有效性表明,这不是影响苯C−H吡啶化性能的唯一参数。
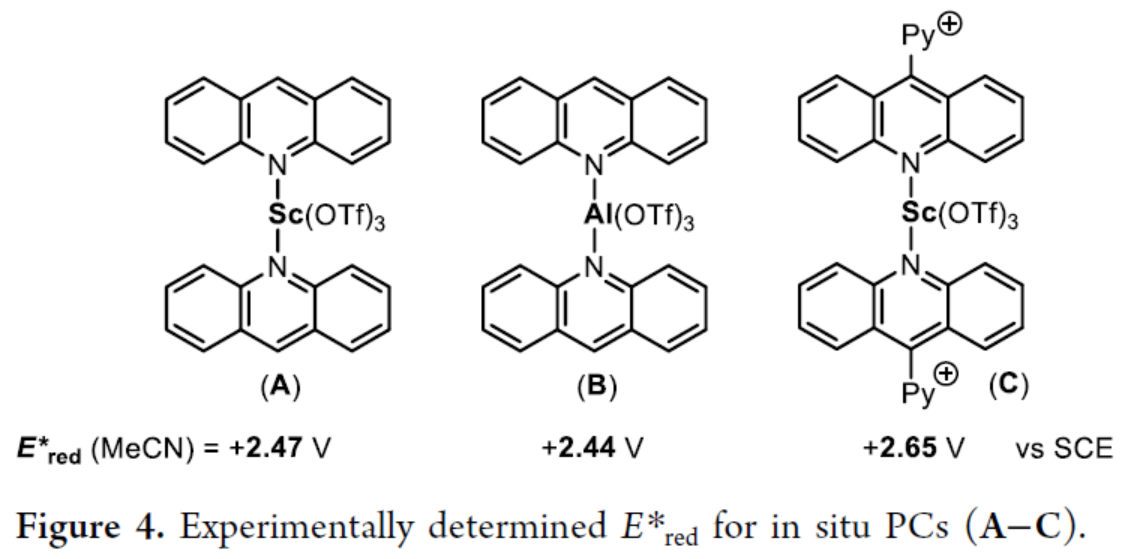
(图片来源:J. Am. Chem. Soc.)
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn