

合成化学为我们的“衣、食、住、行、医”提供了重要的物质基础,是推动人类社会进步的重要驱动力。然而传统的化学合成存在效率低、污染严重等瓶颈问题,与国家所倡导的绿色发展理念相矛盾。因此更加绿色、高效的合成方法亟待开发。相较于传统的化学催化,酶催化具有过程绿色、选择性好、催化效率高等优势,在功能分子例如创新药物的工业化生产中得到了广泛的应用,已成为传统化学合成方法的重要替代者。然而,目前酶催化反应的工具箱还非常有限,能够催化新颖化学转化的酶亟待发现。
狄尔斯-阿尔德反应(Diels-Alder reaction,简称D-A反应)是共轭双烯(二烯体)与取代烯烃(亲二烯体)之间发生的[4+2]环加成反应,最早由德国化学家Otto Diels和他的学生Kurt Alder在1928年首次报道。D-A反应是合成化学中构建C-C键最常用的方法之一,在天然产物全合成、药物分子工业化生产以及材料化学等方面得到了广泛的应用,这两位德国化学家也因为这些贡献而获得了1950年的诺贝尔化学奖。值得一提的是,2021年诺贝尔化学奖得主之一David W.C. MacMillan所开发的有机小分子催化的第一个实例也是D-A反应。
传统化学催化的D-A反应存在着立体选择性差、合成效率低等问题,因此从自然界中挖掘可以立体选择性催化D-A反应的酶受到了化学家们的广泛关注和研究。随着测序技术和生物信息学的发展,数十种可以催化分子内D-A反应的酶被从微生物中鉴定出来,这些酶参与了微生物天然产物中茚(如SpnF)、降冰片烯(如SdnG)、十氢化萘(如PryE3、MycB、Phm7、CghA)、螺环(如PyrI4、PloI4、AbyU、VstJ)、吡啶(如TbtD、TclM、PbtD)、双环[2.2.2]二杂辛烷(如PhqE、MalC、CtdP)等骨架结构的形成。此外,还有一些分子内D-A酶参与了植物中生物碱的生物合成(如CrCS、TiTabS)。
相较于分子内D-A酶,催化分子间D-A反应的酶非常有限,仅有macrophomate 合成酶、riboflavin 合成酶以及催化分子间氧杂Diels-Alder 反应的EupfF。这三个分子间D-A酶除了催化[4+2]环化外,还可催化其他的化学转化,均属于多功能D-A酶。随着对反应机理研究的深入,有些D-A酶被发现并不是通过催化协同的D-A反应机理来构建天然产物中的C-C键。例如,越来越多的证据表明macrophomate 合成酶并不是一个分子间D-A酶,而是一个缩醛酶,它通过分步催化Michael加成和Aldol反应而不是D-A反应实现两个C-C键的构建。因此,从最初D-A反应的发现,到目前为止超过了90年,还没有“真正意义”催化分子间D-A反应的单功能的D-A酶从自然界中被发现。
在植物中存在大量D-A类型天然产物,在它们的生源合成过程中分子间D-A反应是构建其骨架结构的关键步骤,暗示着在植物中可能存在催化分子间D-A反应的酶。然而由于D-A酶的功能特殊性以及植物天然产物生物合成研究的技术难点,长期以来人们对于植物中分子间D-A酶知之甚少。
北京大学雷晓光课题组十多年前开始布局进入新的研究领域,聚焦在植物天然产物生物合成与酶催化方向。基于化学生物学的理念,以活性小分子探针的发现、制备与应用为主要研究方向,探索天然产物全合成与化学生物学、合成生物学的高度交叉与融合,将基于化学思维和手段的技术创新与解决生物学实际问题紧密结合,取得了多项开拓性研究成果。近期,该课题组应邀在Accounts of Chemical Research 杂志上发表综述文章“Hunting for the Intermolecular Diels−Alderase”,系统地总结了课题组围绕分子间D-A酶的发现、机制解析和合成应用等方面所做出的多项科研成果。该文章也将作为封面文章发表。
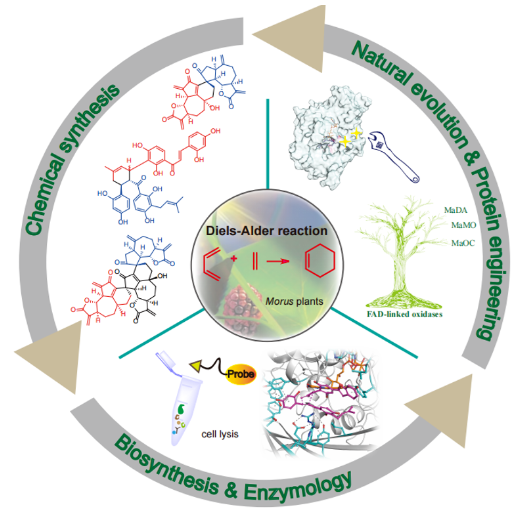
图1. 植物来源分子间D-A类型天然产物的全合成、生物合成与D-A酶机制研究
雷晓光课题组从建组之初就关注植物来源D-A类型天然产物的生源合成研究,在早期的工作中,雷晓光课题组以分子间D-A反应为关键步骤实现了多个倍半萜二聚体以及三聚体的首次全合成(Org. Lett. 2010, 12, 4284−4287;J. Am. Chem. Soc. 2012, 134, 12414−12417;Chem. Sci. 2013, 4, 1163−1167.);后续雷晓光课题组还开发了手性硼酸复合物促进的不对称D-A反应,并利用该反应实现了桑科植物中多个D-A类型天然产物的首次不对称全合成(Angew. Chem., Int. Ed. 2014, 53, 9257−9261;Org. Lett. 2016, 18, 360−363;J. Org. Chem. 2016, 81, 458−468)。通过系统性对植物来源D-A类型天然产物进行仿生合成研究,雷晓光课题组制备了大量生物合成中间体以及产物标准品,同时确立了以桑科植物来源的黄酮类型D-A天然产物作为研究对象进行后续D-A酶的挖掘工作。
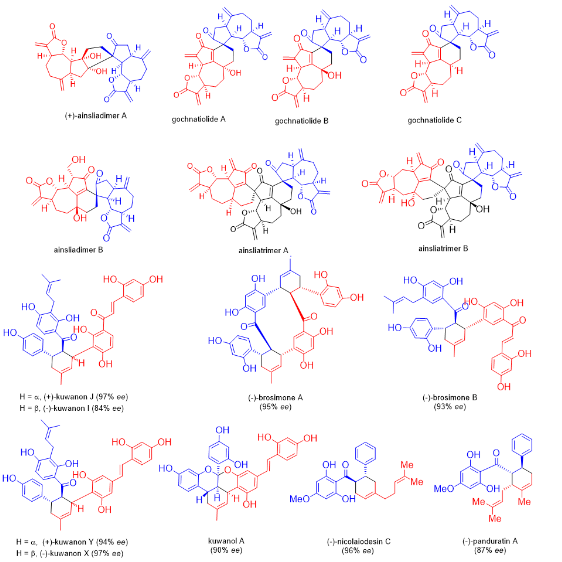
图2. 雷晓光课题组完成的植物来源分子间D-A类型天然产物仿生合成
在前期仿生合成的基础之上,雷晓光课题组与合作者提出了一种新颖的基于生物合成中间体探针分子(biosynthetic intermediate probe, BIP)的靶标垂钓化学生物学策略(BIP-based target identification),并结合传统活性导向蛋白分离以及转录组测序等方法,在白桑愈伤组织中鉴定了自然界中首例催化分子间D-A反应的单功能酶MaDA,并解析了其晶体结构,初步阐明了其催化机制,证明了MaDA所催化的分子间 [4+2] 环加成反应是一个协同但不同步的Diels-Alder反应,由此证明了MaDA是首个真正意义上的分子间D-A酶,从而结束了学术界一直存在的“自然界是否有真正意义DA反应酶”的争论(Nat. Chem. 2020, 12, 620−628)。
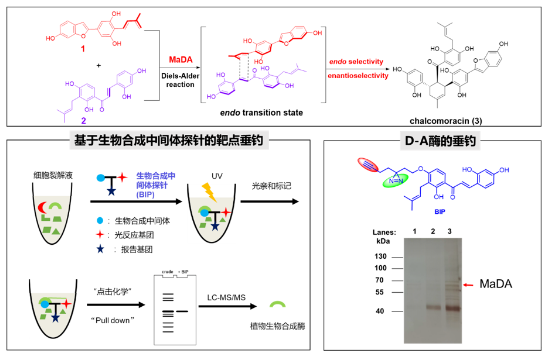
图3. 利用生物合成中间体探针在桑树中鉴定了首例分子间单功能D-A酶
在从桑科植物中鉴定了首例单功能分子间D-A酶MaDA之后,雷晓光课题组利用基于同源性的反向遗传学方法对桑树中MaDA同源蛋白进行了挖掘和功能表征,在白桑中发现了一类全新的exo选择性分子间D-A酶,为通过酶催化的手段实现催化剂控制的exo选择性D-A反应中提供了全新的工具。此外,雷晓光课题组还解析了exo选择性D-A酶的晶体结构,通过结构比对、计算化学、突变实验等手段鉴定了不同endo/exo选择性D-A酶的催化位点,阐明了它们的不同催化机制,为D-A酶的改造应用提供了理论基础(Nat. Catal. 2021, 4, 1059−1069)。
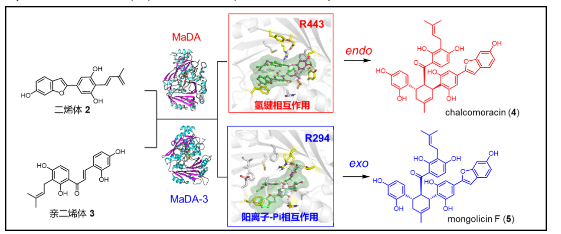
图4. 不同endo/exo 选择性分子间D-A酶的催化机制解析
在阐明桑科植物中分子间D-A酶的催化机制后,雷晓光课题组也针对其自然演化机制开展了研究。通过对桑树中类BBE家族蛋白进行进化树分析、祖先序列重构、结构解析、计算化学、突变验证等实验,雷晓光课题组系统揭示了桑树中分子间D-A酶从氧化环化酶演化产生的机制。在这一过程中,氧化环化酶经过基因复制事件,形成了D-A酶及其功能相关的二烯体合成酶的共同祖先。在D-A酶演化过程中,祖先酶通过四个关键氨基酸残基的替换(A357L、S348L、D389E和H418R)获得了催化分子间Diels-Alder反应的能力。此外,突变如I417L和L387Y显著增强了Diels-Alder活性,而I156V等突变则有效降低了原有的氧化环化活性,推动了氧化环化酶向单功能D-A酶的功能转变。在D-A酶进化过程中,这四个关键突变对于祖先酶底物结合模式的微调起到了至关重要的作用。祖先氧化环化酶原本只能竞争性容纳单一底物,而通过引入这些关键突变位点后,祖先酶能够容纳两个底物以进行D-A反应,从而获得D-A反应活性(Nat. Commun. 2024, 15, 2492,)。该研究不仅深化了我们对D-A酶形成机制的理解,也加深了我们对植物天然产物结构多样性的酶学机制的认识,更重要的是,它为新颖D-A酶的理性挖掘和改造提供了重要的理论指导,对于D-A酶的进一步开发和利用具有重要科学意义。
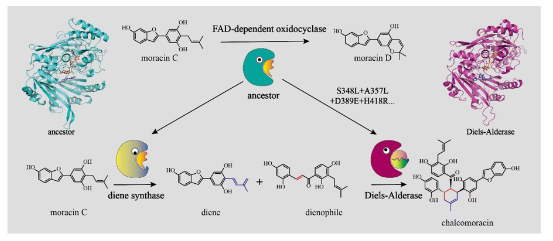
图5. 桑树中分子间D-A酶的自然演化机制
在获得了可以催化不同endo/exo选择性分子间D-A反应的新颖酶催化工具后,雷晓光课题组还系统性探索了这两类酶的合成价值。利用这两类酶的立体专一性和底物宽泛性,雷晓光课题组实现了四十余个桑科植物D-A类型天然产物及其类似物的高效、精准合成(Nat. Catal. 2021, 4, 1059−1069,;Biotechnol. J. 2020, 15, 2000119)。然而,这两类酶催化工具依然具有底物局限性。为了进一步拓展D-A酶的合成应用范围,雷晓光课题组针对D-A酶MaDA1进行了蛋白工程改造,并通过将酶催化的D-A反应与金属催化脱羧官能团化反应巧妙结合,利用生物催化与化学催化相辅相成和优势互补的特点,实现了环己烯骨架的多样性导向、精准合成。该研究工作为结构多样的六元环骨架合成提供了新思路,拓展了D-A酶的催化应用范围。
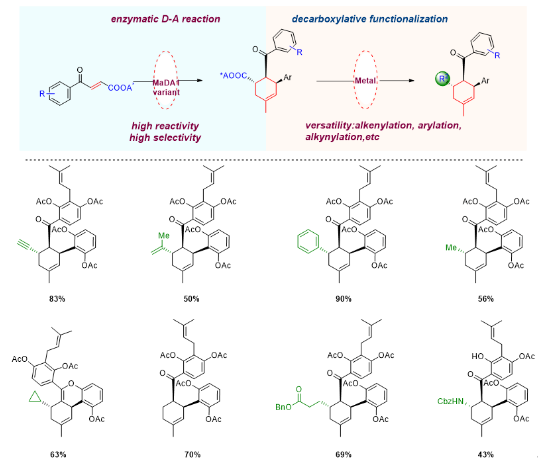
图6. 利用多样性导向的化学-酶法合成策略实现了结构多样的环己烯骨架化合物的立体选择性合成
基于在植物来源D-A酶方面所取得了重要研究成果,雷晓光课题组应邀以“Hunting for the Intermolecular Diels−Alderase”为题在美国化学会的Accounts of Chemical Research 杂志上发表综述,详细总结了基于仿生合成和化学蛋白质组学去发掘植物中新颖工具酶的植物天然产物生物合成研究新范式;详细介绍了新颖D-A酶的催化以及自然演化机制,为新颖D-A酶的理性挖掘和改造提供了重要的理论指导;并提出了多样性导向的化学-酶法合成新策略,整合脱羧官能团化反应和酶促D-A反应各自的优势,实现了D-A产物的高效衍生和制备,为D-A类型天然产物的药物开发奠定了重要物质基础(Acc. Chem. Res. 2024, DOI: 10.1021/acs.accounts.4c00315)。此文章中,雷晓光课题组的特聘副研究员高磊博士为第一作者,博士毕业生丁琪博士为第二作者;雷晓光教授为该论文通讯作者。
原文(扫描或长按二维码,识别后直达原文页面):

Hunting for the Intermolecular Diels–Alderase
Lei Gao, Qi Ding, and Xiaoguang Lei*
Acc. Chem. Res., 2024, DOI: 10.1021/acs.accounts.4c00315
导师介绍
雷晓光
https://www.x-mol.com/groups/leigroup
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn