


正文
构筑C-N键以制备芳香胺类化合物已成为全球范围内学术界和工业界广泛关注的五大反应之一。早在20世纪初,过渡金属催化就在胺类化合物和卤代芳烃的偶联反应中崭露头角,如Ullmann芳胺化、Buchwald-Hartwig偶联和Chan-Lam偶联更是在这一领域中获得了非常广泛的应用(图1a)。然而,尽管它们用途广泛,这些反应却离不开使用预制备卤代芳烃或者芳基硼酸酯,过渡金属催化剂和配体。从产物中去除过渡金属残留也一直是制药工业中长期面临的挑战之一。近几年,自由基反应在C(sp2)-H键官能化中展现出独特优势,特别是通过自由基偶联策略在构建C-N键中表现出巨大的潜力(图1b)。但是,由于自由基偶联策略的成功应用需要自由基的极性必须与芳烃相匹配,缺电子N自由基易与富电子芳烃反应而不易和缺电子芳烃如硝基芳烃反应,反之亦然。这也导致目前为止自由基加成反应的底物范围通常不好。同时,反应中底物极性匹配的要求也导致了大多数芳烃C-H键官能化时得到多种反应位点选择性的混合物。
南昌大学化学化工学院蔡琥教授团队与与武汉大学雷爱文教授近期合作,使用稳定、低成本且市售易得的硝基芳烃作为卤代芳香烃和芳香硼酸的等价体,在无需过渡金属催化剂和光电的条件下,首次实现了硝基芳烃与胺的高对位选择性自由基偶联芳胺化反应(图1c)。该策略对一系列官能团兼容,并可实现克量级扩大规模的制备,不仅解决了自由基偶联策略中自由基与芳烃的极性匹配要求导致底物局限于富电子芳烃和芳烃芳胺化时得到多种反应位点选择性混合物的难题,同时也避免了从产物中去除过渡金属残留这一制药工业中长期面临的挑战。
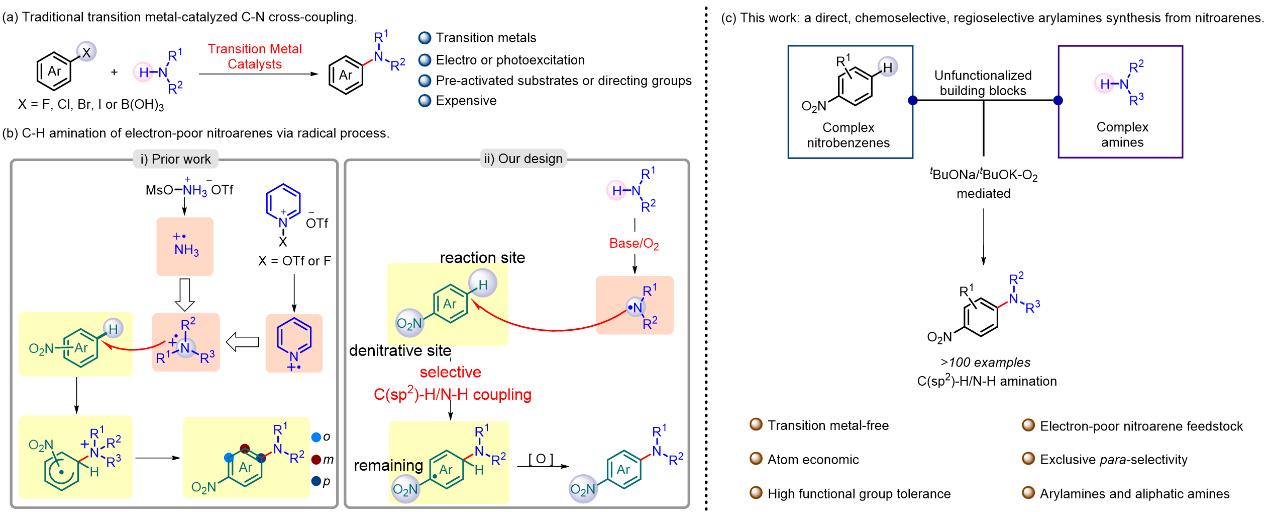
图1. 芳胺化反应研究。图片来源:Nat. Commun.
在优化的条件下,作者对硝基芳烃的高选择性对位自由基偶联芳胺化反应进行了底物范围考察(图2)。含有多种官能团的伯、仲芳胺甚至吲哚在反应体系中都能被良好兼容。相比于芳胺,脂肪胺(如烷基胺、吡咯烷、吗啉等)作为自由基前体形成的氮自由基稳定性差,通常会发生自由基移位,形成稳定的α-氨基烷基自由基。然而,含有多种官能团的伯、仲脂肪胺依然能够在该反应体系中被良好兼容。

图2. 胺类底物拓展。图片来源:Nat. Commun.
硝基芳烃作为一类重要的有机合成子,在药物、染料、材料等领域都发挥着重要作用。为此,作者也深入探讨了硝基芳烃类底物的范围。在温和的条件下,该反应仍然获得高选择性对位自由基偶联芳胺化产物,并表现出很好的官能团耐受性(图3)。在苯环的邻位或间位上,给电子基团(-Me,-OMe,-SMe)和吸电子基团(-F,-Cl,-Br,-CN,-NO2,-CF3,-CONH2,-COOMe)都在强碱条件下具有良好的兼容性。
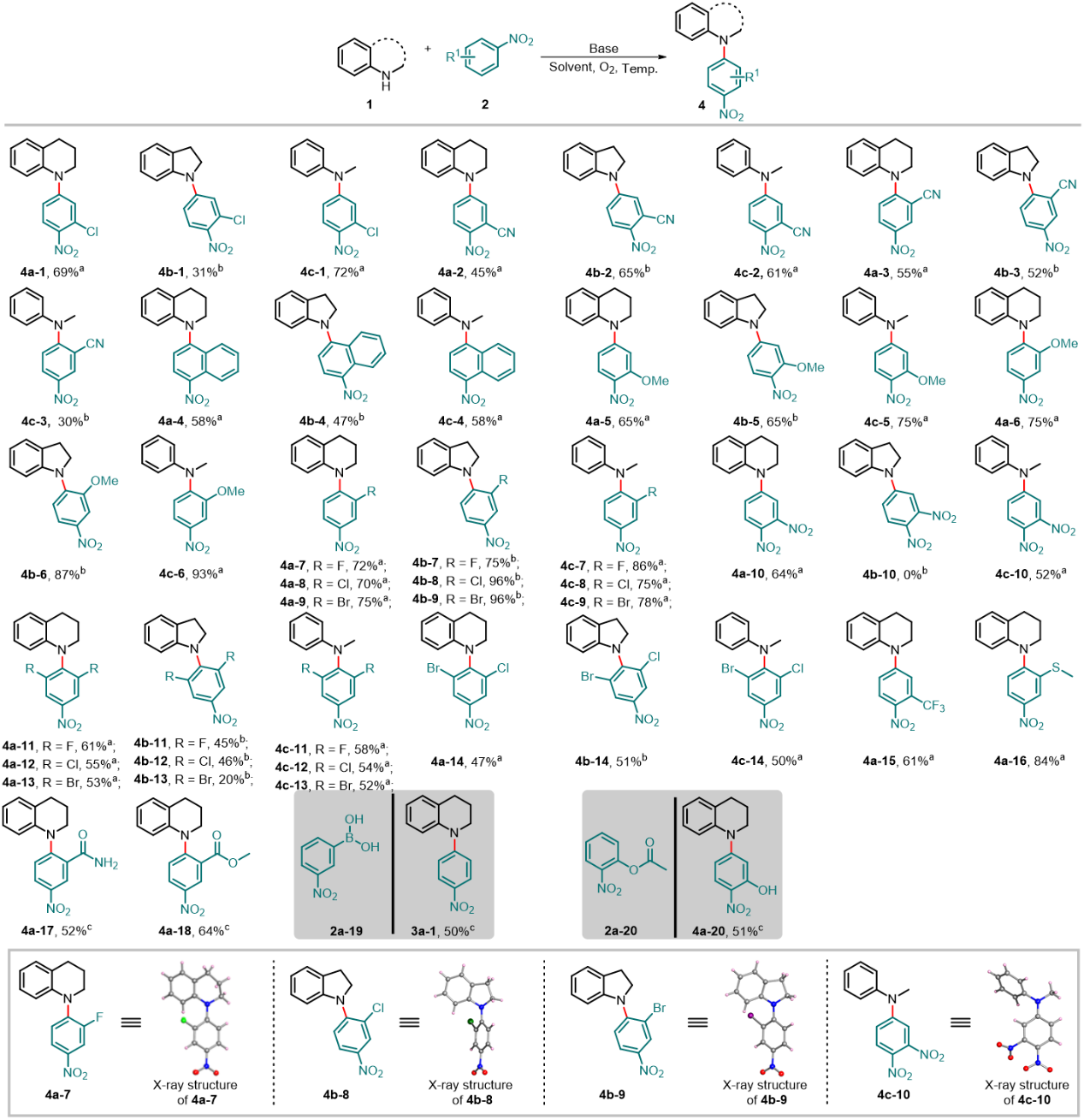
图3. 硝基芳烃类底物拓展。图片来源:Nat. Commun.
为了探究反应机理,作者进行了一系列的验证实验,并证明该反应经历了自由基偶联过程(图4)。在反应体系中,碱和O2均是必须的,并且与光无关。在标准条件下,单独加入苯胺只会生成经由苯胺氮自由基偶联的产物偶氮苯。对于脂肪胺类底物而言,碱的种类至关重要:tBuONa作为碱时仅会生成氧化偶氮苯;然而,当使用tBuOK作为碱时反应才能够有效地进行。此外,自由基时钟实验进一步证明了该反应经历了自由基过程。
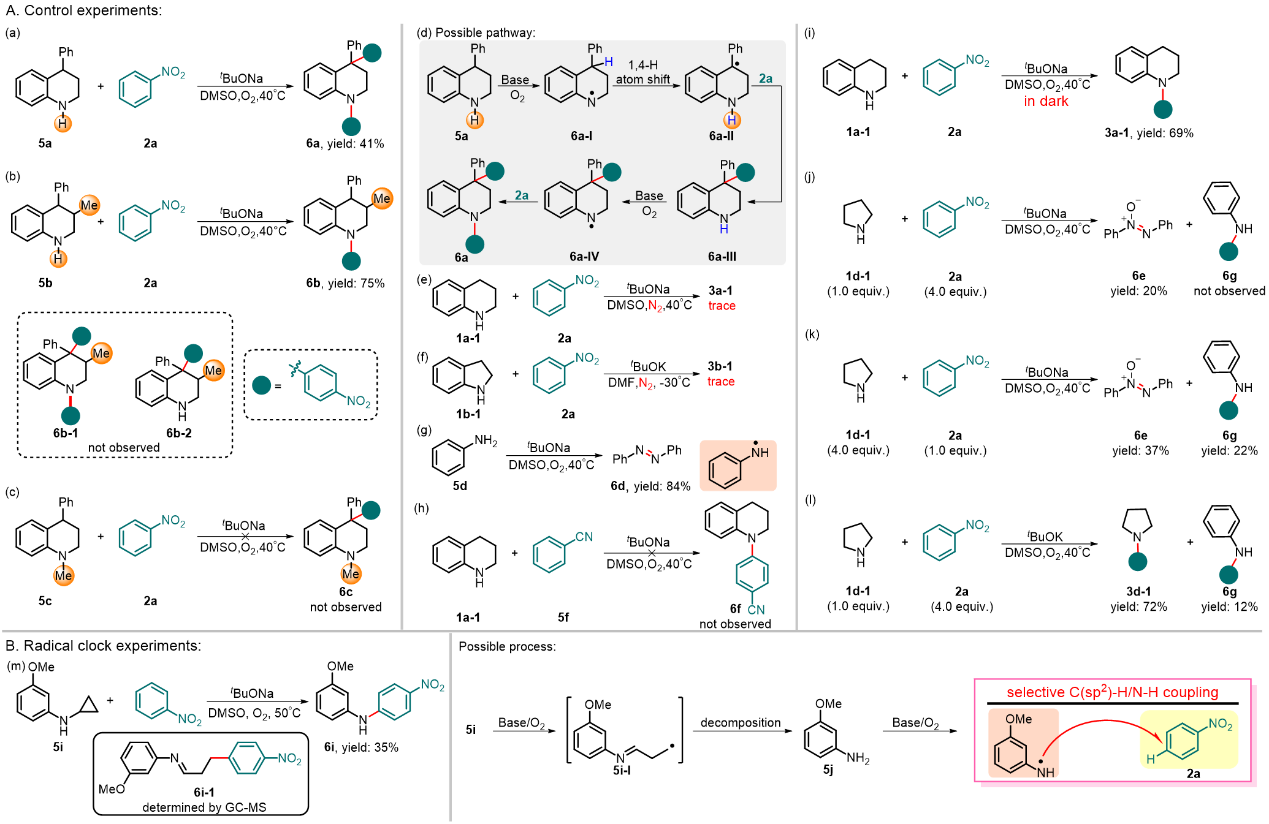
图4. 反应机理探究。图片来源:Nat. Commun.
同时,作者还利用电子顺磁共振(EPR)也进一步验证了自由基机理(图5)。在反应体系中加入1a-1会产生氮自由基,但当没有2a发生偶联反应时,氮自由基在DMSO/tBuONa/O2体系中很容易通过Korcek’s radical-trapping antioxidant(RTA)过程转化为N-O自由基(g = 2.0054,AN = 11.5 G)。此外,碱和O2对于氮自由基的形成是必不可少的。
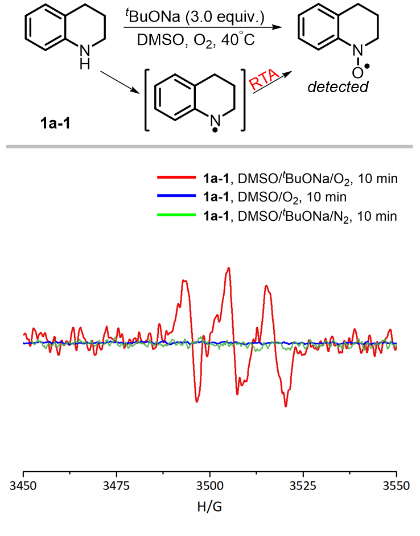
图5. EPR测试。图片来源:Nat. Commun.
通过密度泛函理论(DFT)计算,作者得知:在tBuONa/DMSO/O2体系中,1a-1-radical可以选择进攻2a中硝基的对位或邻位,从而会对应产生两个反应位点的过渡态TS1和TS1'。ΔG(TS1)比ΔG(TS1’)更低,说明与对位反应会更优先,也就生成了对应的INT1。这也解释了为什么在反应中得到了反应位点完全在硝基对位的区域选择性。最终,作者结合DFT计算提出了一种可能的反应机理(图6)。
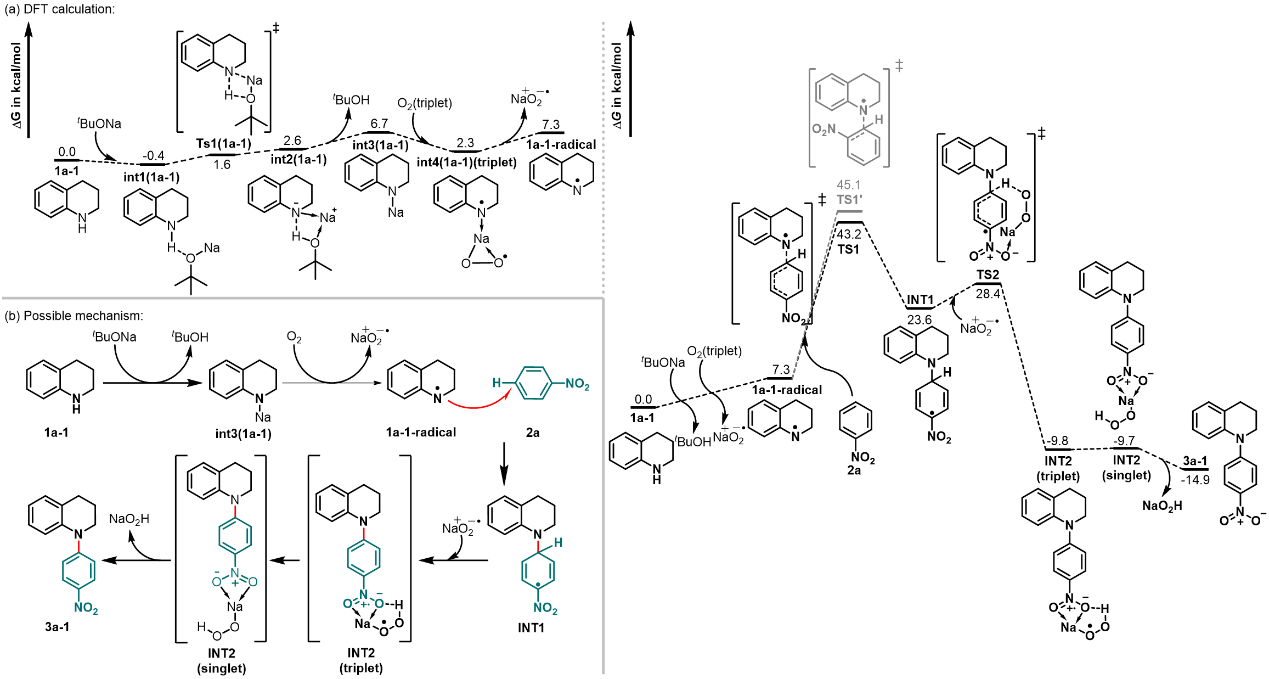
图6. DFT计算及可能的反应机理。图片来源:Nat. Commun.
作者成功地利用硝基芳烃与胺的高对位选择性自由基偶联芳胺化反应体系高效合成并转化了三苯胺类衍生物(图7)。3c-10克量级规模的合成进一步证明了该合成策略在工业中的应用潜力。另外,作者通过采用反硝化转化策略,利用“合成上游”硝基芳烃实现了功能化芳烃的直接合成。
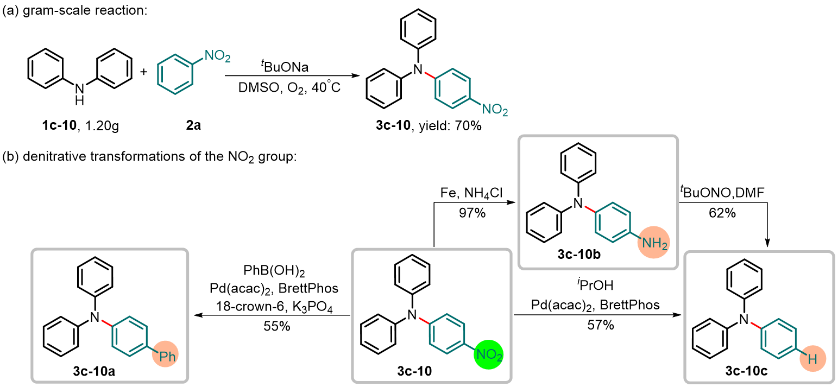
图7. 克量级规模合成和反硝化转化策略。图片来源:Nat. Commun.
总结
课题组简介

蔡琥:博士生导师,南昌大学赣江特聘教授、香樟杰才;1990年本科毕业于兰州大学化学系有机化学专业,1996年研究生毕业于南京大学化学化工学院有机化学专业,1999年博士毕业于南京大学化学化工学院无机化学专业,先后在美国田纳西大学化学系、凯斯西储大学化学系和堪萨斯大学环境友好催化中心作为博士后和副研究员从事研究工作;目前主要从事绿色有机合成以及有机功能分子材料的精准合成及其在光电、传感以及信息存储材料方面的应用研究;先后获得江西省“新世纪百千万人才工程”人选、江西省“双千计划”科技创新高端人才、国务院侨办重点华侨华人创业团队等称号;先后主持国家自然科学基金5项,科技部中小企业创新基金1项,参与科技部重大研究计划1项。在J. Am. Chem. Soc.、Angew. Chem. Int. Ed.、Nat. Commun.、Chem. Commun.、Organ. Lett.、Org. Chem. Front.、Green Chem.等国内外重要学术刊物上已发表论文100余篇,获批授权专利20余件。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn