

正文
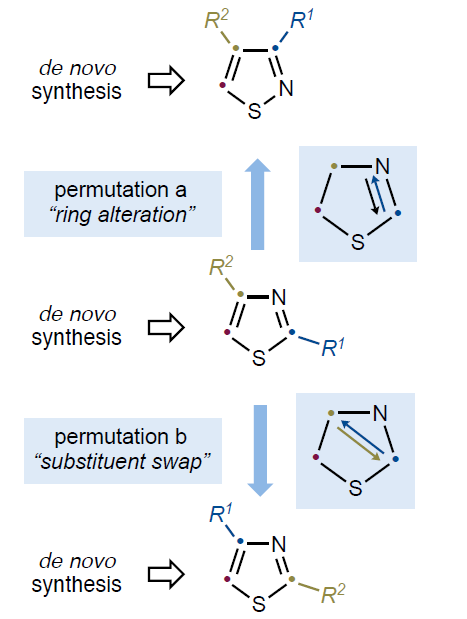
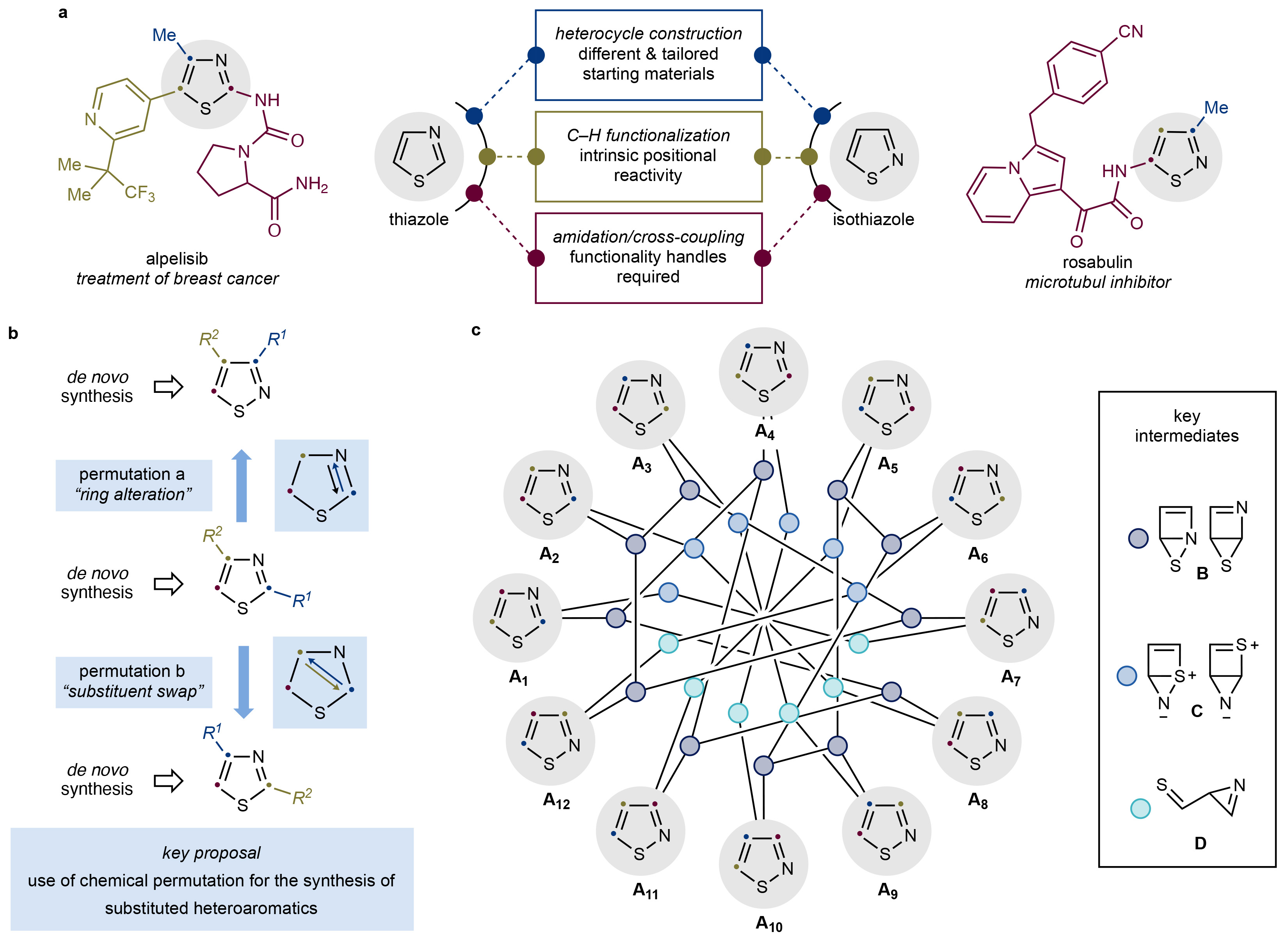
噻唑和异噻唑类化合物是是药物和农用化学品中的重要结构骨架。此类化合物的合成通常是根据具体实际情况来设计和开发的。然而在有些时候,由于缺乏针对特定目标的可靠合成方法,使得合成过程具有很大的困难,甚至会阻碍特定化合物的进一步研究。最近,德国亚琛工业大学Alessandro Ruffoni和Daniele Leonori课题组联合报道了在光照射下,噻唑、异噻唑、苯并[d]异噻唑、吲唑、吡唑和异噁唑等一系列唑类化合物通过对π, π*单线态轨道的填充,并经历了一系列的结构重排,从而实现了环系及取代基的整体重构(Fig. 1)。
(图片来源:Nature)
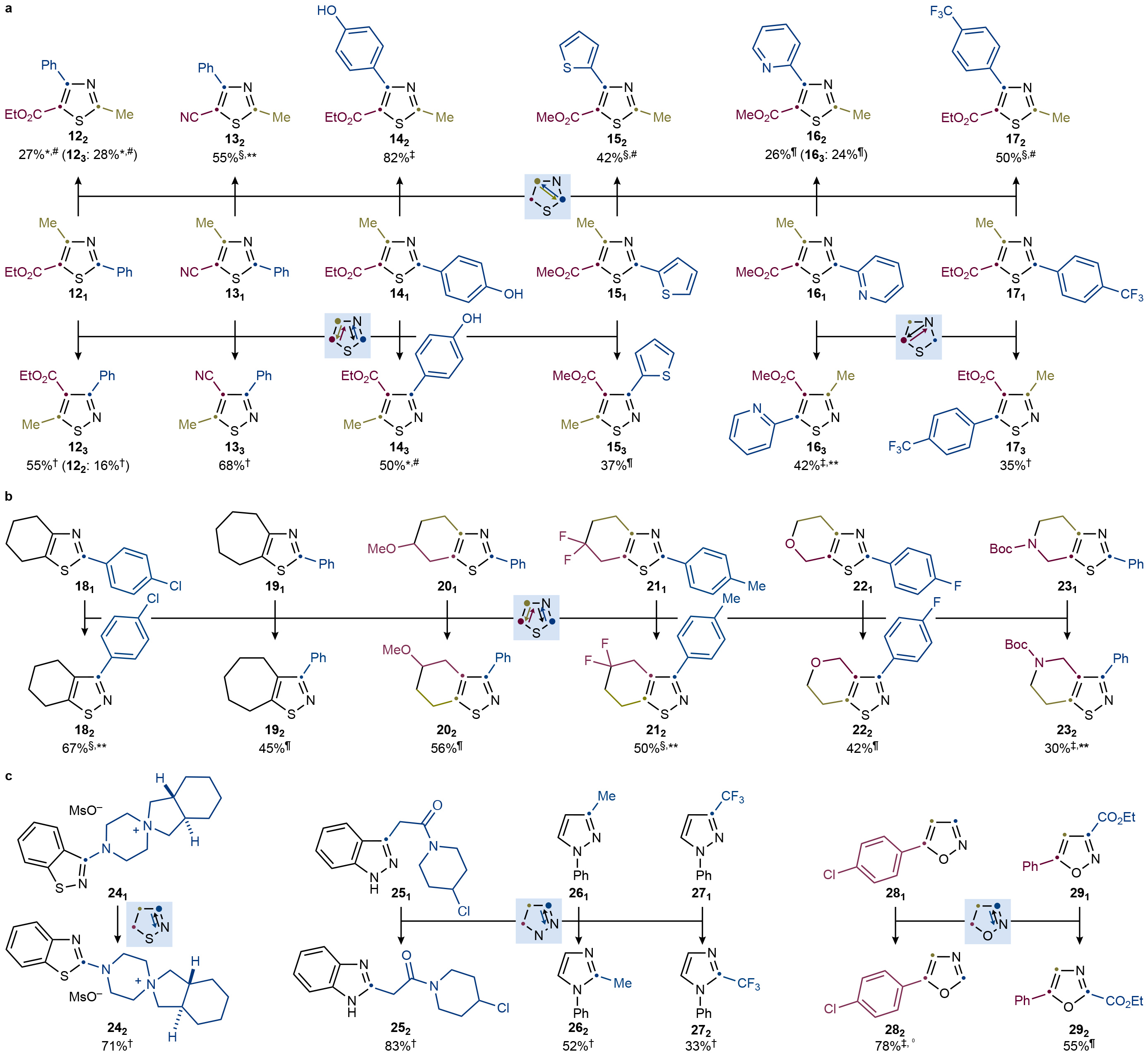
首先,作者专注于单取代噻唑/异噻唑的结构重排,并评估了具有六个含苯基衍生物11-16的反应性(Fig. 2a)。通过对光化学稳定性的初步研究,作者确定了C4-苯基噻唑12和C3-苯基异噻唑14在室温光照(λ = 310 nm,16小时)下在几种溶剂中基本稳定。接下来,作者探索其它衍生物转化为12和/或14的合成方法。通过一系列的探索,作者发现电子效应对转化的定向性影响很小,这由将11-16的p-OMe和p-CF3衍生物置于类似的反应条件中的结果得到证明。
随后,作者通过计算对11➔12与11➔14的转化进行研究,初步了解了重排过程的定向性(Fig. 2b)。在光照下,11填充了其处于π,π*构型的单线态激发态。以上确定了S1/S0锥形交叉是无障碍的,并导致Dewar中间体B1的形成。虽然此物种可以转化为11,但通过“硫原子行走”到B2的能垒更低。这个共价键互变异构体在热力学上更加稳定,并且可以通过电环裂合环得到12。作者基于其光稳定性的观察得出,其光激发应该在热弛豫后形成而不是形成B2后进行的。确实,其对应的S1/S0锥形交叉点在几何上与11的锥形交叉点有很大不同,并且与基态12非常相似。作者认为这可能是控制排列定向性的关键因素。此外,作者还考虑了从B2进行进一步的“硫原子行走”,因为这可能会导致14的B3的形成。通过分析作者得出通过B2形成12在热力学上是可行的。然而,由于B2➔B3的转化也是一个可以达到的能垒,作者提出溶剂效应足以干扰整个体系,从而在特定条件下形成14。
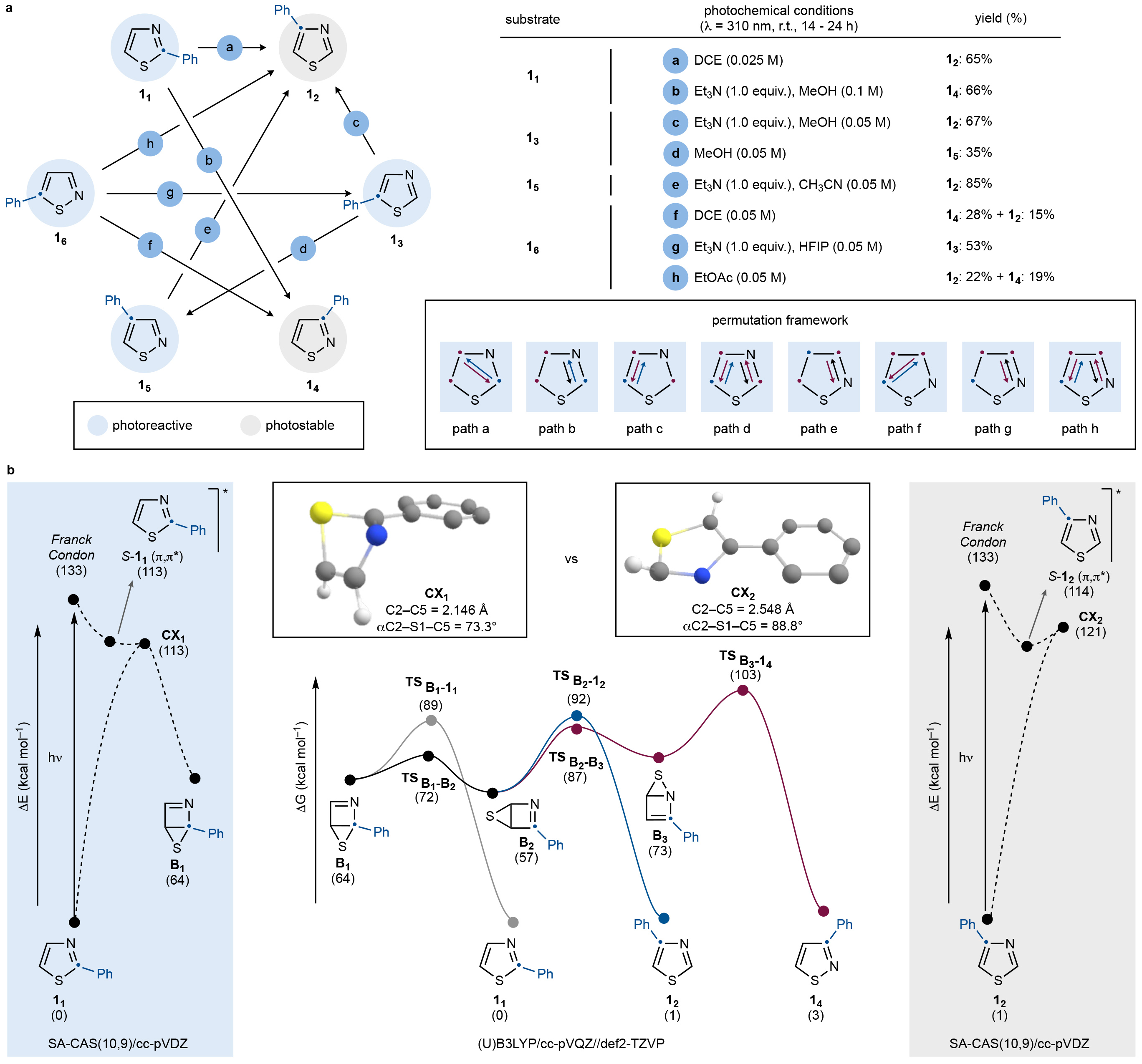
(图片来源:Nature)
为了继续探索这种重排方法的反应性,作者在对一系列连有Ph、Me和H取代基的噻唑/异噻唑衍生物进行了探索(Fig. 3a)。一般来说,底物遵循了在六个Ph取代的衍生物11-16中得出的反应性趋势。因此,C2-Ph-噻唑类化合物21和22分别转化为28(途径a)或23(途径b)以及24(途径d)或27(途径c),产率中等。有趣的是,尽管22的重构需要添加Et3N,但作者偶然发现N,N'-二甲基硫脲(DMT)有助于改善21的反应产率。C5-Ph-噻唑类化合物25在MeOH中照射后选择性的得到了异噻唑29(途径f)或210(途径e),这主要是由于Et3N的存在。异构体26只能转化为29(途径g),这种重构过程的产率较高。最后,C4-Ph-异噻唑类化合物210可以得到噻唑24(途径h),而C5-异噻唑类化合物211和212被选择性地转化为23(途径j)或28(途径i)以及29(途径k)或27(途径l)。
接下来,作者评估了吸电子的酯基官能团的影响(Fig. 3b)。随后由于缺乏合成方法,无法完成合成出所有的苯基和酯二取代衍生物。但通过排列化学,可以方便地得到异噻唑37,并进一步证明其与噻唑33一样具有光稳定性。因此,在作者鉴定的六种可能的噻唑衍生物中,作者发现31、32和34均具有反应性。此外,三氟甲基同样可以兼容。总的来说,作者通过对这三类底物(11-16;21-212;31-37)的评估为实验提供了指导。
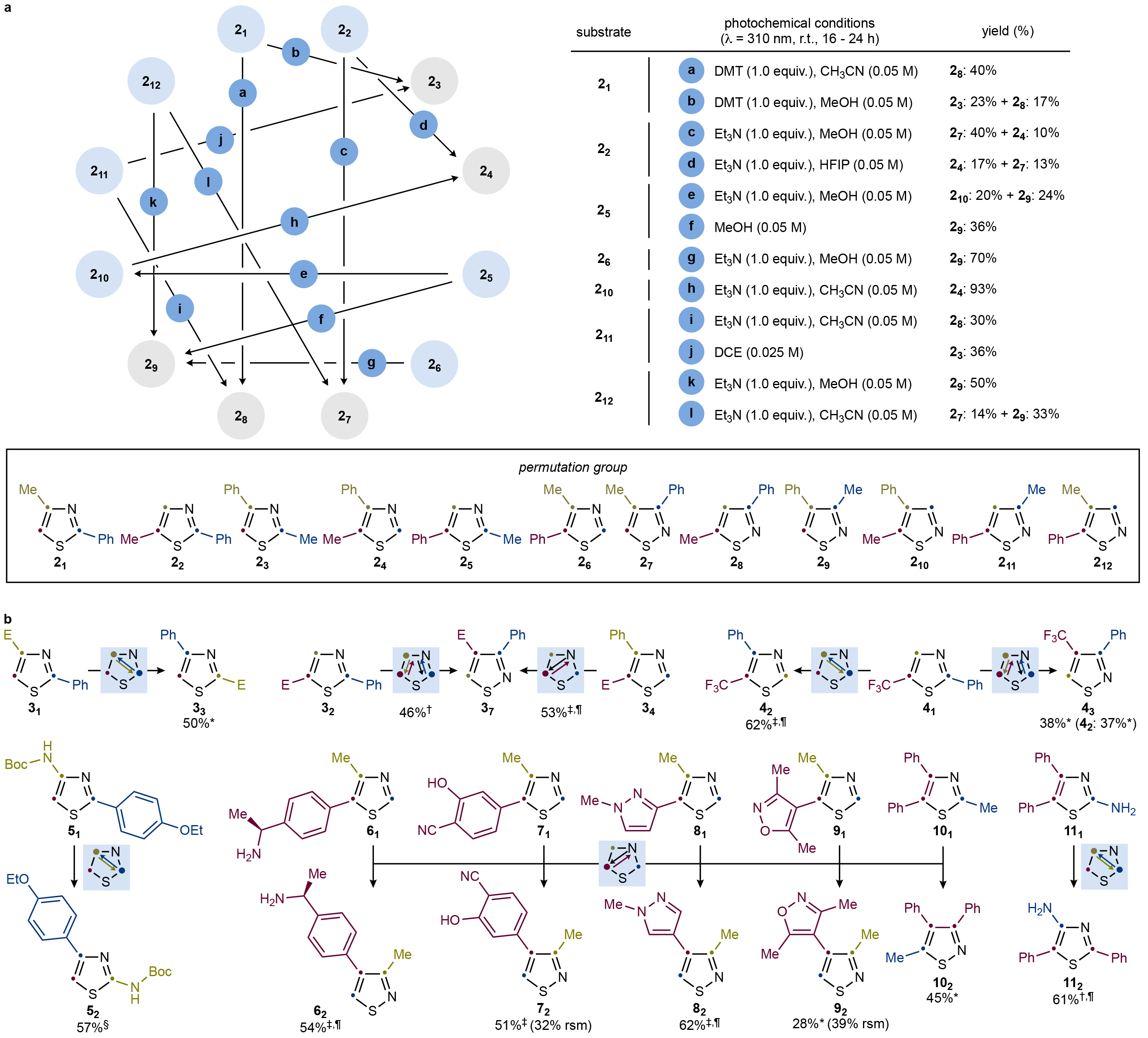
(图片来源:Nature)
接下来,作者应用此策略实现了含有三个不同取代基的噻唑121-171的转化,分别以26-82%的产率得到相应的重排产物122-172,以及以35-68%的产率得到异噻唑产物123-173(Fig. 4a)。此外,此策略还可以扩展到双环噻唑,以30-67%的产率得到相应的异噻唑产物182-232(Fig. 4b)。值得注意的是,此策略还可以拓展到其它的唑类化合物,包括苯并[d]异噻唑、吲唑、吡唑和异噁唑均可顺利参与反应,得到相应的产物242-292(Fig. 4c)。
(图片来源:Nature)
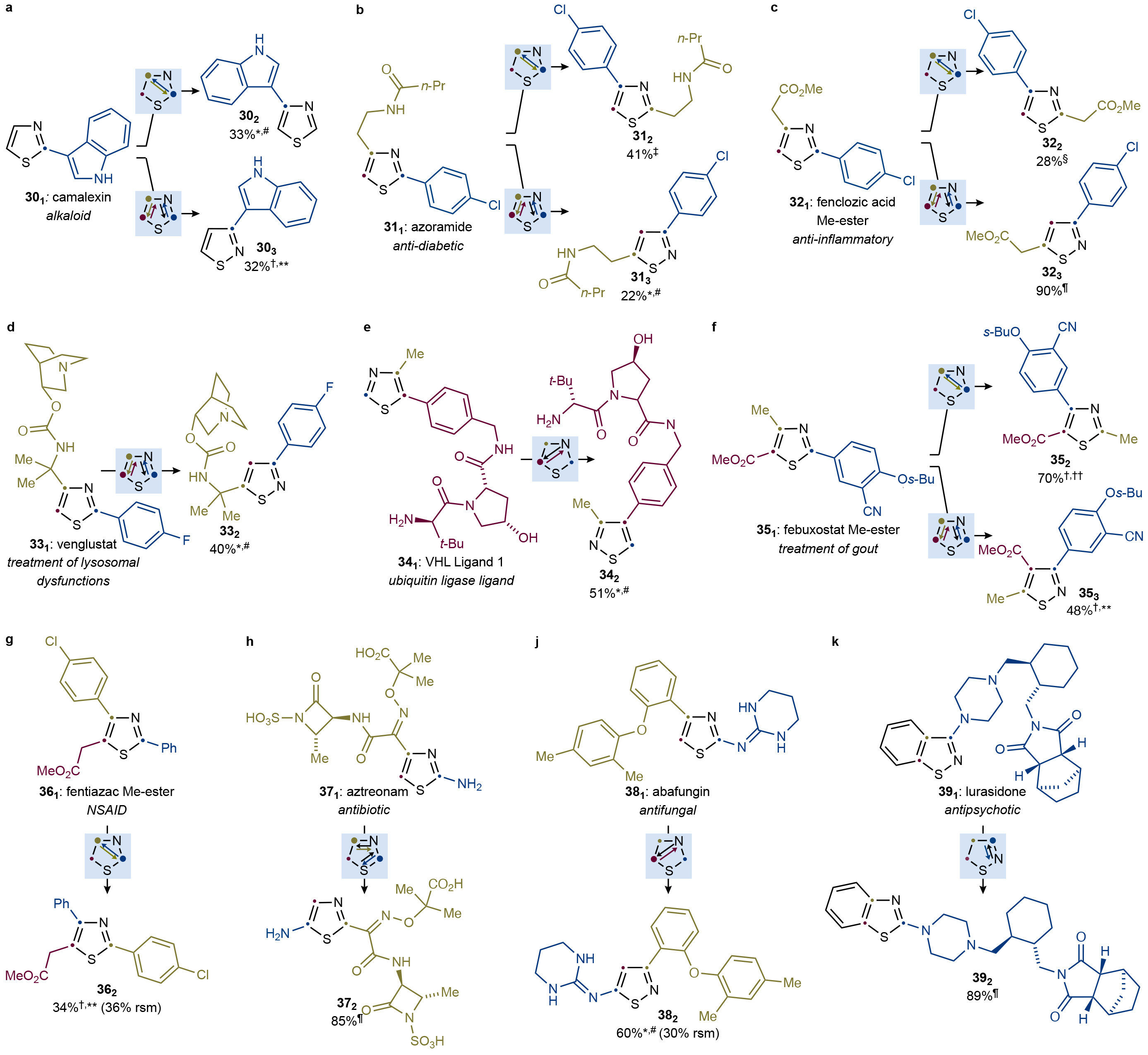
为了进一步证明此转化的实用性,作者探索了生物活性分子在此转化中的兼容性(Fig. 5)。实验结果表明,包括吲哚天然产物camalexin (301),抗糖尿病试剂azoramide (311),Venglustat (331),VHL 配体 (341),Febuxostat (351),fentiazac (361), Aztreonam (371),abafungin (381),lurasidone (391)在内的复杂生物活性分子均可顺利参与转化,以22-90%的产率得到相应的产物302-392,303-323,353,由此证明了此策略的实用性。
(图片来源:Nature)
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn