

多种实体肿瘤,至今仍缺乏有效的治疗方法,临床治疗通常需要多种药物联合使用。例如,胶质瘤是成人中最常见的原发性恶性脑肿瘤,单靠外科切除往往无法治愈。患者的预后较差,肿瘤复发率较高,五年生存率仅为5%,目前可用的治疗方式极为有限。考虑到肿瘤基因组的复杂性以及涉及的多条信号通路,单一的治疗方式可能无法有效应对。因此,亟需针对不同致癌通路的组合治疗方法。
雷帕霉素靶蛋白(mTOR)是一种在哺乳动物细胞中起着关键作用的蛋白激酶,参与细胞生长、增殖和存活等过程,同时也在脑胶质瘤的发生发展中发挥重要作用。然而mTOR激酶抑制剂的选择性差导致了较高的毒性和较差的临床安全性,同时耐药性问题进一步削弱了其临床疗效。这些因素极大地限制了mTOR抑制剂的临床应用,至今尚未有除雷帕霉素之外的mTOR抑制剂获批上市。。
分子胶技术是一种新型的药物开发方法,近年来受到了广泛关注。该方法通过诱导靶蛋白降解来调节蛋白功能,以催化循环和事件驱动的作用模式,有望克服小分子抑制剂的耐药性。G1到S期过渡蛋白1(GSPT1)主要调控蛋白翻译终止过程,并与多种肿瘤的发生发展密切相关。GSPT1在胶质母细胞瘤细胞中高表达,通过长链非编码RNA MINCR调控miR-876-5p/GSPT1轴,促进胶质母细胞瘤的进展。目前已有多种GSPT1降解剂被报道,并且一些已进入临床研究阶段。
有研究表明,mTOR抑制剂耐药原因之一可能是由于GSK3β表达量降低引起,而GSPT1的降解会促使GSK3β的表达上调,有望克服其耐药。与此同时,mTOR的抑制能有效增强GSPT1降解剂活性。此外,mTOR抑制和GSPT1降解在细胞翻译的始末具有协同作用。因此同时抑制mTOR并降解GSPT1为恶性肿瘤提供了一种新的联合治疗策略。
2024年12月3日,清华大学药学院饶燏团队于《Journal of the American Chemical Society》(美国化学会志)上在线发表了题为“A dual-target and dual-mechanism design strategy by combining inhibition and degradation together”的研究文章。在这项研究中,作者开发了一个双靶双机制小分子YB-3-17,它能够高效、选择性地抑制mTOR同时降解GSPT1,对肿瘤细胞增值抑制活性优于单一治疗及其联合使用。此外,YB-3-17能够在小鼠模型中安全有效地抑制肿瘤的生长。作者首次将mTOR抑制与GSPT1蛋白降解结合起来,展示了将小分子抑制剂和降解剂特性成功整合到单一分子中的概念性与可行性,“一石二鸟”的策略有望达到“事半功倍”的效果,为胶质瘤的精准治疗提供了一个有前景的方向。

首先基于双靶双机制的设计理念,作者结合多种mTOR抑制剂与E3泛素连接酶配体,并考虑分子胶的特性,构建了独特的分子胶化合物库(图1A)。研究人员经过多轮筛选后得到了一个苗头化合物YB-2-43,并经过进一步优化后得到活性最优的双功能分子YB-3-17(图1A)。该分子能够高效抑制mTOR并降解GSPT1(图1B, C)。
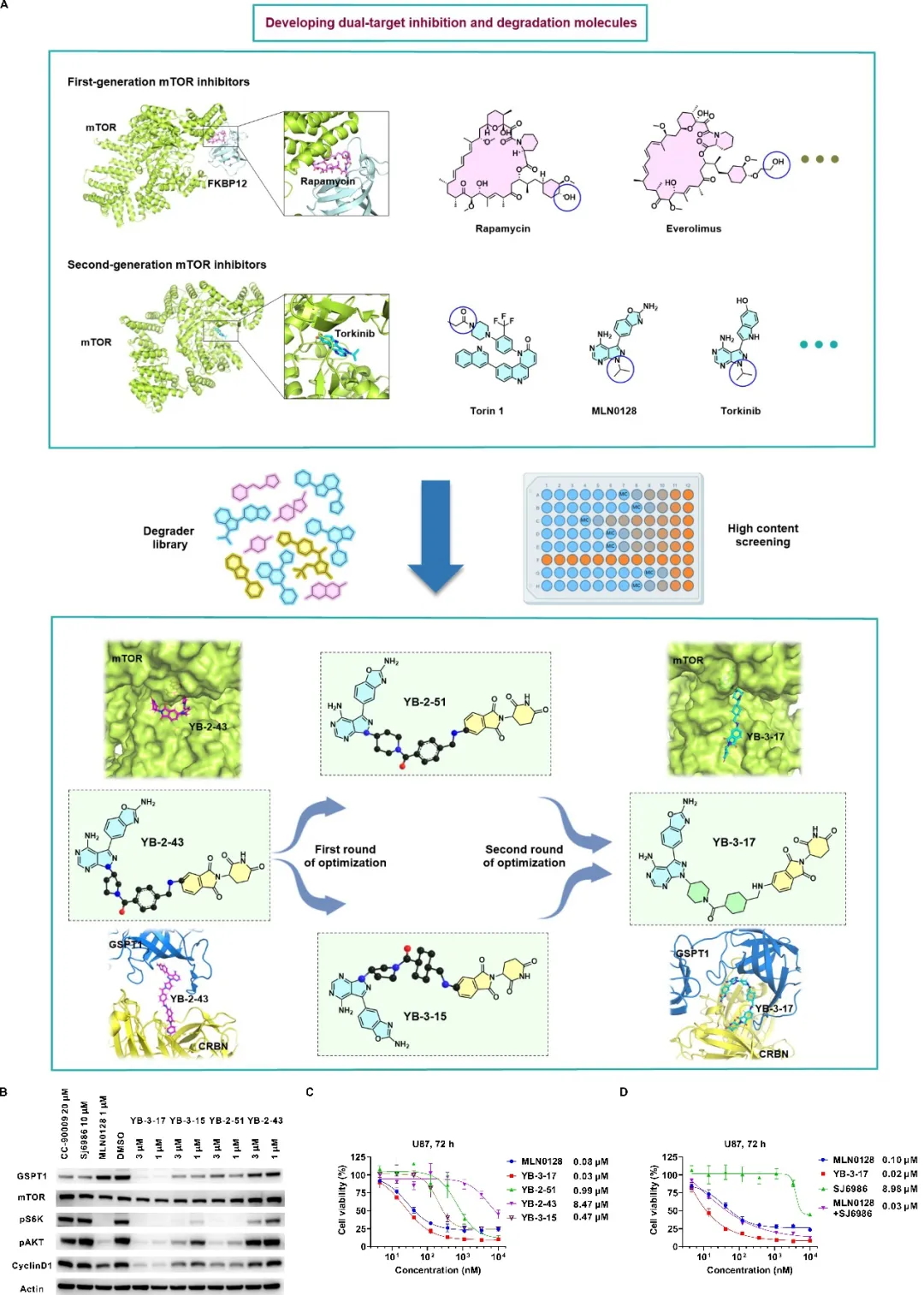
图1. 双靶双机制小分子YB-3-17的开发及评价
随后,作者对YB-3-17进行了进一步的生物学活性评估以及机制验证。如图2A所示,YB-3-17能明显抑制mTORC1/2复合物并降解GSPT1,显著抑制其下游蛋白的磷酸化水平,并且呈现出良好的时间和浓度依赖性。YB-3-17能够在低至10 nM的浓度下有效降解GSPT1,DC50仅5 nM。此外,rescue竞争性实验表明YB-3-17诱导GSPT1降解依赖于泛素蛋白酶体系统(图2B)。作者还测试发现YB-3-17对mTOR的酶活IC50仅为0.22 nM,甚至略优于抑制剂MLN0128(IC50 = 0.47 nM)(图2C)。同时,作者发现YB-3-17能够有效抑制多种神经肿瘤细胞的增殖,IC50值低至3.3 nM(图2D),优于单靶点mTOR抑制剂(MLN0128)、GSPT1降解剂,以及它们的联合治疗(图1D),显示出作用于双靶点的协同效应。
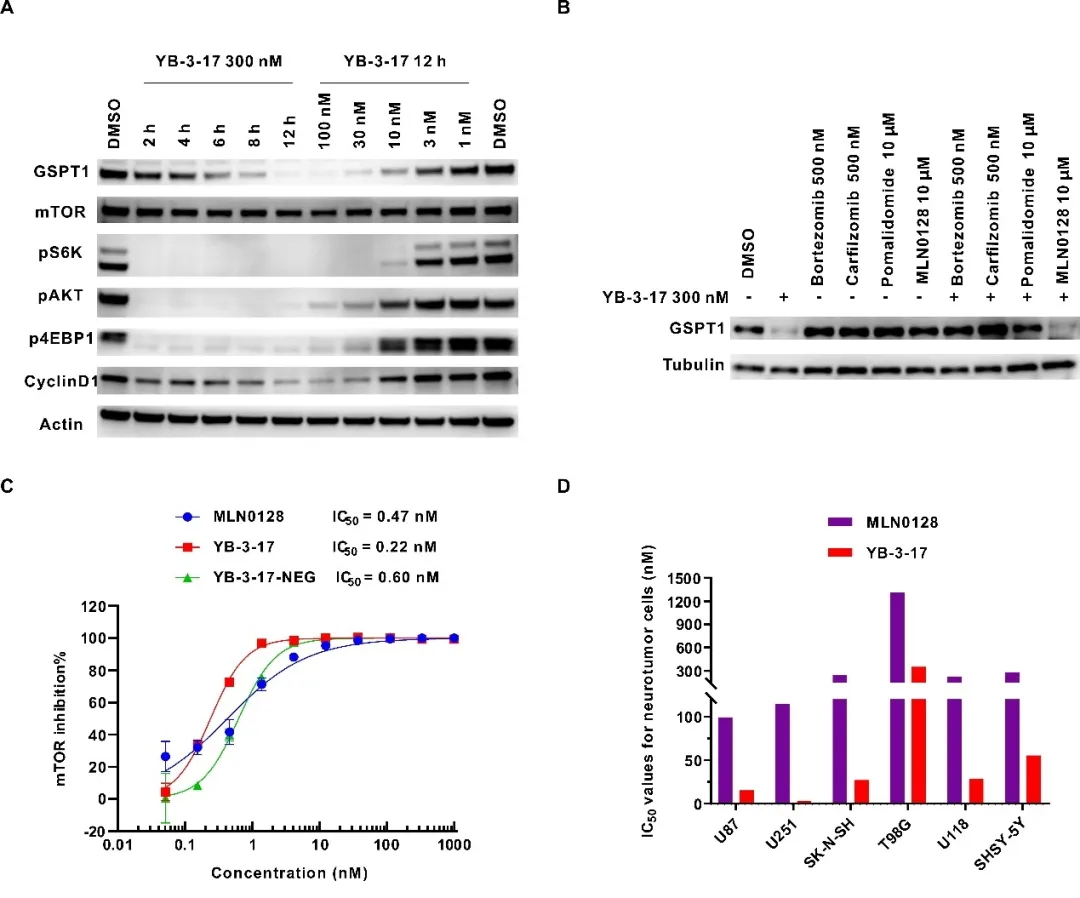
图2. 双靶双机制小分子YB-3-17的活性评估及机制验证
作者对YB-3-17选择性进行了进一步的详细评估。通过蛋白质组学和激酶谱实验表明了YB-3-17同时具有优良的GSPT1降解和mTOR抑制选择性(图3A, B, C)。基于此,作者还做了一个初步的体内实验对YB-3-17的安全性进行了测试(图3D)。30 mg/kg的mTOR抑制剂MLN0128给药一次会导致小鼠死亡,10 mg/kg 的MLN0128连续给药三天则导致小鼠体重显著下降。与之相比,30 mg/kg的YB-3-17连续给药三天小鼠依然状态良好。表明YB-3-17具有较高的体内安全性,也进一步反映出其优良选择性。
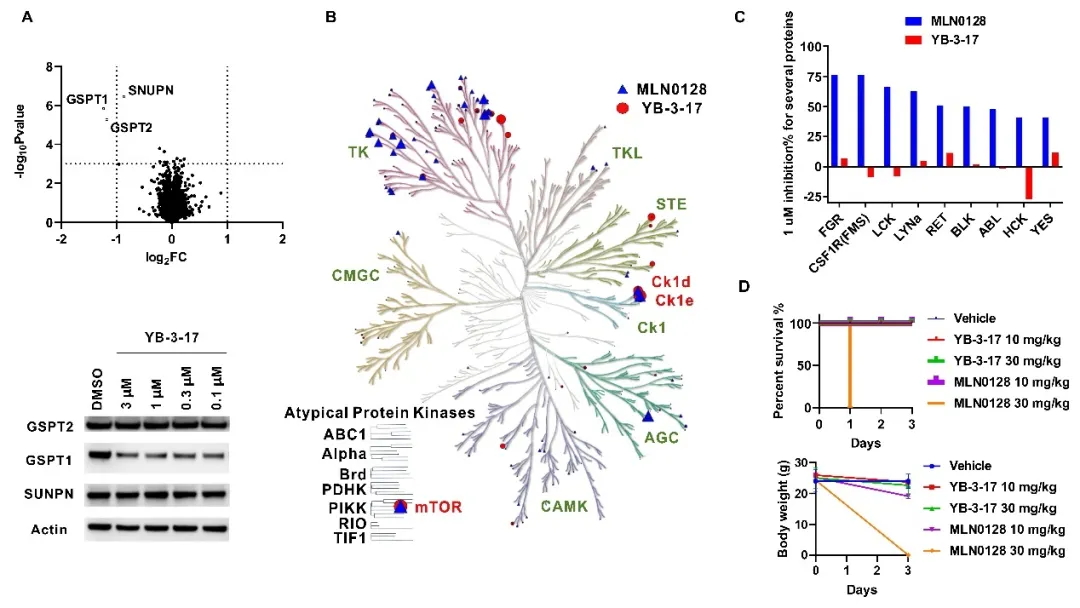
图3. 双靶双机制小分子YB-3-17的选择性及安全性评估
最后,作者评估了YB-3-17在小鼠模型上的体内抗肿瘤活性。尽管MLN0128和YB-3-17均显著抑制了肿瘤生长,然而,YB-3-17在相等剂量下表现出更强的疗效,例如2.5 mg/kg的YB-3-17产生了与10 mg/kg MLN0128相当的肿瘤抑制效果。值得一提的是,10/20 mg/kg的YB-3-17几乎完全阻止了肿瘤的生长,并导致肿瘤消退,且小鼠状态良好(图4B)。显示了YB-3-17在体内强效的抗肿瘤能力及可靠的安全性。与溶媒组相比,YB-3-17显著抑制了mTOR下游蛋白的磷酸化,并以剂量依赖的方式降解GSPT1(图4C)。
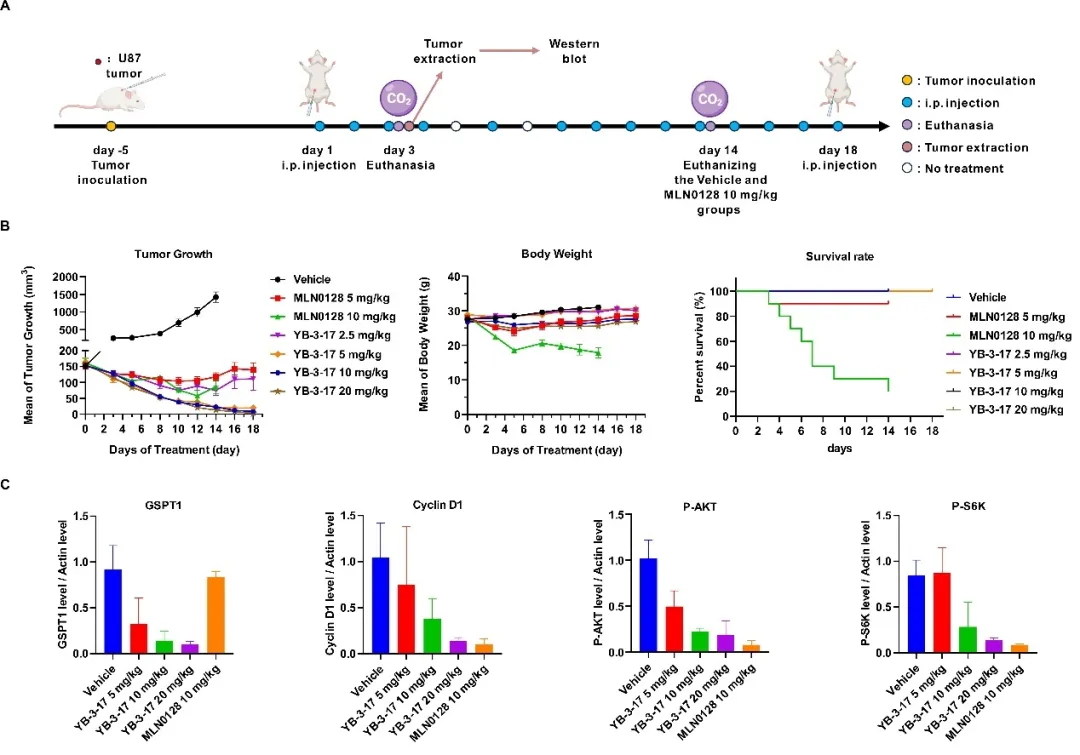
图4. 双靶双机制小分子YB-3-17的体内抗肿瘤活性评估
总之,作者提出了同时抑制并降解两种不同靶蛋白的双靶双机制小分子设计策略,创新地开发了小分子YB-3-17。该分子能选择性且高效地抑制mTOR并降解GSPT1。与临床中mTOR抑制剂MLN0128相比,YB-3-17在体内外的抗肿瘤效果均具有显著优势且安全性更佳。YB-3-17以“一石二鸟”特性实现了“事半功倍”的效果,验证了双靶点、双机制策略的可行性,为脑胶质瘤提供了新的治疗思路。
饶燏团队长期从事蛋白质靶向降解技术的开发工作,致力于发展新型降解技术及其应用,已取得了一系列研究进展:开发靶向难成药靶点E3连接酶(Smurf1)的降解剂(Nature Chemical Biology 2024);发展基于降解的蛋白质分析(Degradation-Based Protein Profiling,DBPP),并将其应用于中药活性成分的靶点鉴定(Advanced Science 2024);将PROTAC首次应用于相分离,建立了基于PROTAC的BRD4相分离研究新方法(Cell Discovery 2023);提出了 PROTAC 和分子胶协同应用的模式,首次设计合成了新型双靶、双机制的降解剂,为靶向降解技术的发展提出了新的思路(Cell Research 2021);实现难成药靶点的药物开发,设计合成全球首例选择性CDK2降解剂,实现AML高效且低毒的分化治疗(Nature Chemical Biology 2021);构建PROTAC系统性敲除模型,快速可逆实现大动物体内蛋白敲除(Cell Discovery 2019);构建新型CDK4/6降解剂,有效抑制肿瘤增殖(Journal of Medicinal Chemistry 2019);构建高效的BTK降解剂,解决临床中出现的Ibrutinib耐药问题(Cell Research 2018;Leukemia 2019)。此次研究也是该团队进一步拓展分子胶设计策略方面的应用。
清华大学药学院饶燏课题组博士生刘永波为该论文共同第一作者,清华大学饶燏教授与昌平实验室孙秀云副研究员为论文共同通讯作者。本研究得到国家自然科学基金委、科技部、昌平实验室、北京市教委和北京生物结构前沿研究中心的共同资助。
科学家 小档案 饶燏 清华大学药学院 1999年本科毕业于山东医科大学药学院(现山东大学药学院),2002年硕士毕业于沈阳药科大学,2007年于美国佐治亚大学化学系获博士学位,2007-2010年在纽约Memorial Sloan-Kettering Cancer Center从事博士后研究,2010年1月入职清华大学任教至今。2014年起分别任美国化学学会杂志ACS Medicinal Chemistry Letter编委,Chinese Journal of Medicinal Chemistry《中国药物化学杂志》编委及Cancer Innovation 副主编。饶燏教授实验室聚焦药物发现的化学生物学研究,长期深耕蛋白靶向降解技术PROTAC与分子胶领域。课题组通过跨学科交叉,综合运用包括药物化学,化学生物学,结构生物学,高通量筛选等多学科技术手段,来寻找新型安全、高效的小分子化合物应用于临床转化医学研究。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn