

(图片来源:Nat. Catal.)
正文
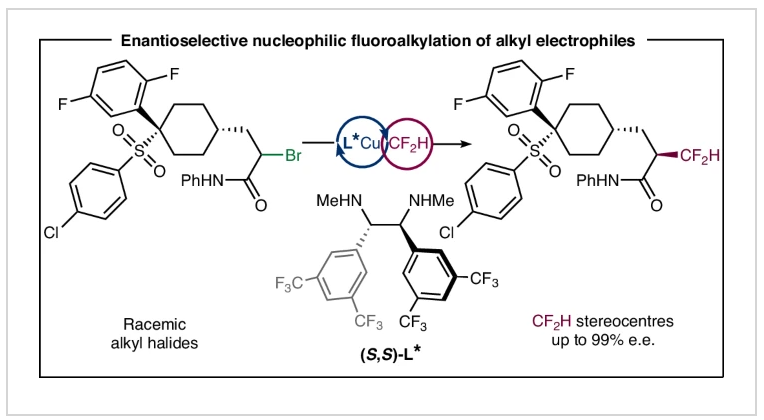
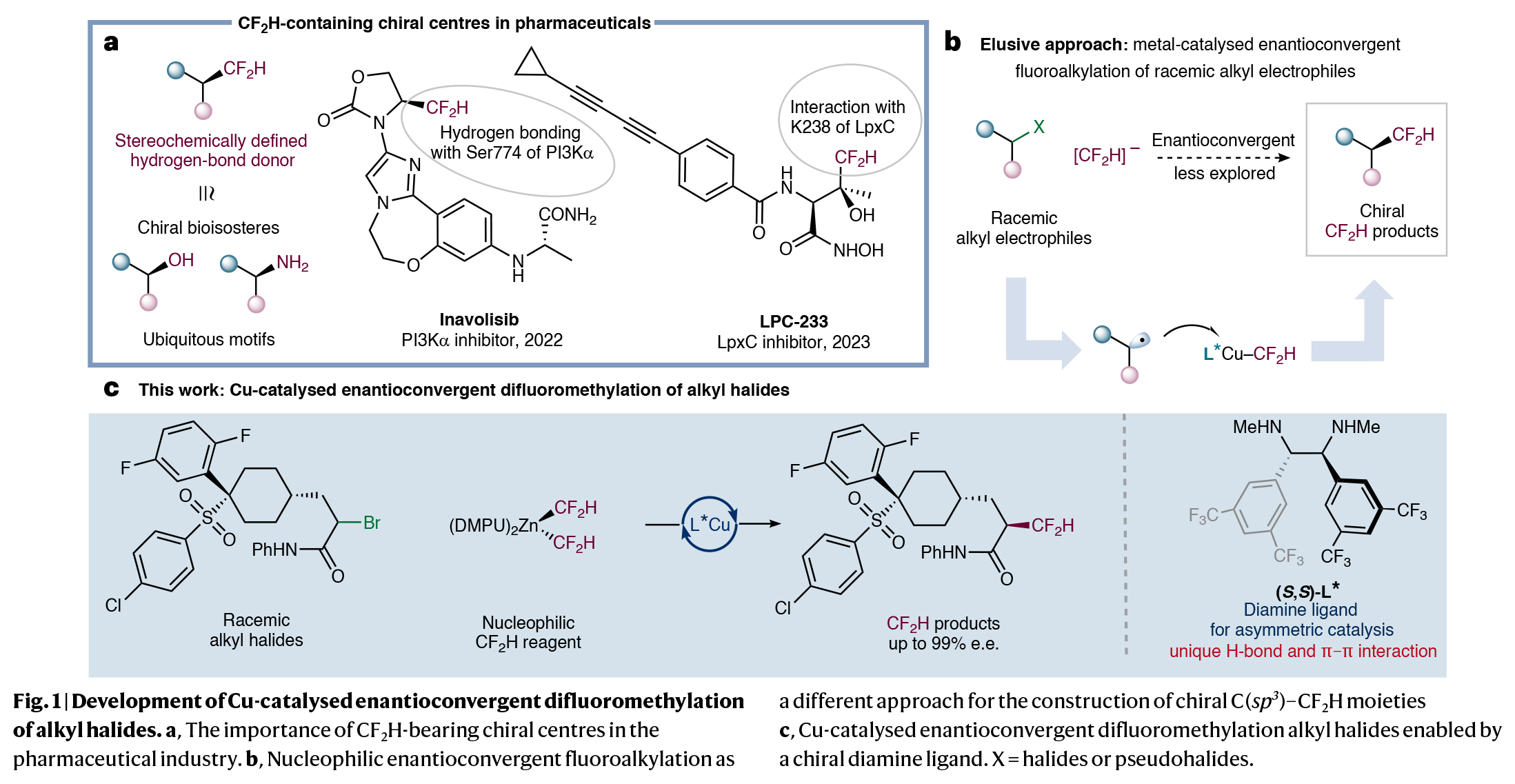
立体化学控制的氢键供体在制药工业中发挥着重要作用。因此,连有二氟甲基(CF2H)手性中心的有机分子由于其独特的氢键性质而成为药物中的关键结构单元。然而,高对映选择性的实现CF2H基团引入的通用策略仍然有待进一步发展。近期,美国辛辛纳提大学Wei Liu课题组发展了一种通过烷基自由基中间体进行的对映选择性二氟甲基化反应模式,高效实现了多种具有优异对映选择性的含CF2H分子的合成。DFT计算表明手性二胺配体和底物之间的氢键和π-π相互作用是实现此转化的关键。欢迎下载化学加APP到手机桌面,合成化学产业资源聚合服务平台。
(图片来源:Nat. Catal.)
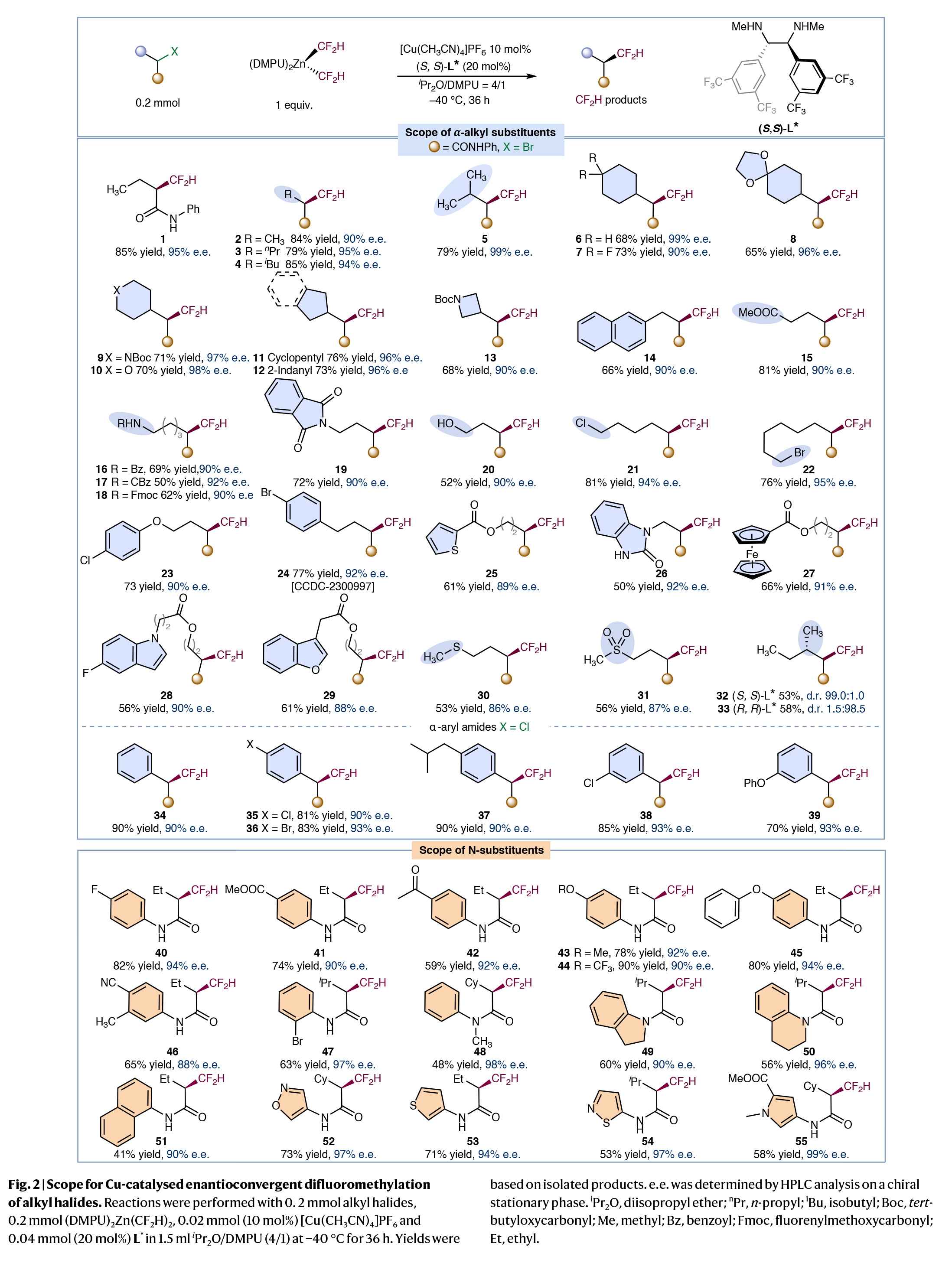
首先,作者探索生物活性分子中经常出现的α-卤代酰胺的二氟甲基化反应。通过对反应条件和反应试剂的一系列筛选,作者发现当使用α-卤代酰胺(1.0 equiv), (DMPU)2Zn(CF2H)2 (1.0 equiv), [Cu(CH3CN)4]PF6 (10 mol%), (S,S)-L* (20 mol%), 在iPr2O/DMPU (4/1)中,−40 °C 反应36 h可以以85%的产率和95%的ee得到二氟甲基化产物1。值得注意的是,反应中所使用的亲核CF₂H锌试剂(Vicic-Mikami试剂)以及连有缺电子苯基配体的使用是实现这一转化的关键。此外,低温反应条件是实现反应不对称诱导所必需的。在得到了最优反应条件后,作者对此转化的底物范围进行了考察(Fig. 2)。实验结果表明,一系列不同α-烷基取代、α-芳基取代以及具有不同氮取代基的烷基溴化物和烷基氯化物具有良好的兼容性,以41-90%的产率,良好的对映选择性得到相应的产物1-55。其中包括烷基、烷氧基、酯基、卤素、氰基、杂环、砜基、硫醚、芳基、杂芳基等一系列官能团均可兼容。
(图片来源:Nat. Catal.)
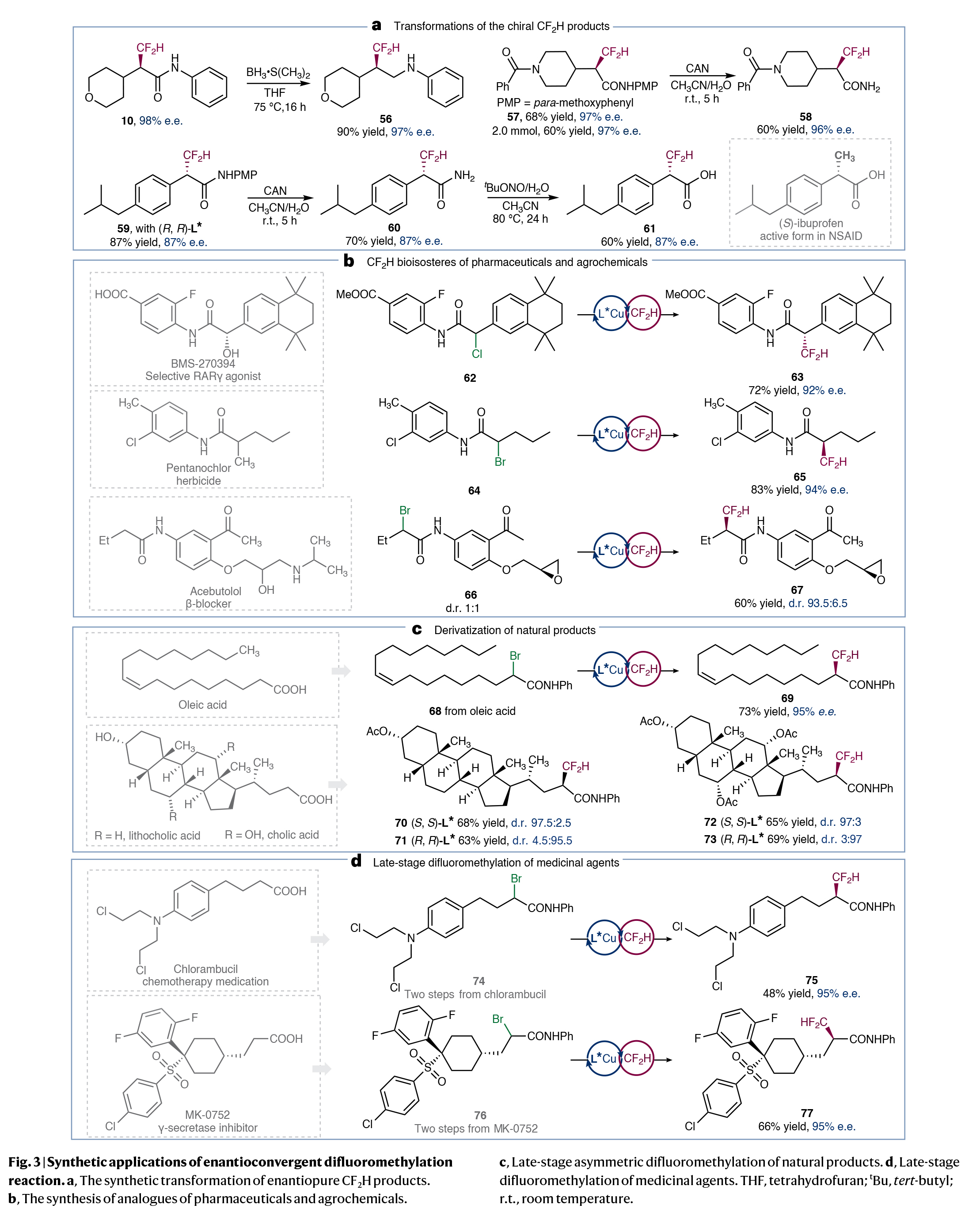
为了证明此转化的实用性,作者进行了合成应用(Fig. 3)。首先,作者利用所得到的二氟甲基化产物分别实现了酰胺羰基的还原、脱PMP保护以及酰胺的水解等过程,且对映选择性可以基本得到保持(Fig. 3a)。此外,作者从相应的苄氯以87%的产率和87%的ee合成了含CF₂H酰胺59。其可以经历两步合成(S)-布洛芬的二氟甲基类似物61。值得注意的是,利用此策略还可以实现药物和天然产物(BMS-270394;pentanochlor;acebutolol)的CF2H生物电子等排体的合成(Fig. 3b)以及天然产物(oleic acid;cholic acid;lithocholic acid)的衍生化(Fig. 3c),证明了此转化的实用性。此外,策略还可以成功应用在药物的后期二氟甲基化(Fig. 3d):例如,化疗药chlorambucil和γ-分泌酶抑制剂MK-0752可以转化为相应的烷基溴化物(74和76),并在标准条件下实现二氟甲基化,分别得到CF₂H产物75(48%,95% ee)和77(66%,95% ee)。
(图片来源:Nat. Catal.)
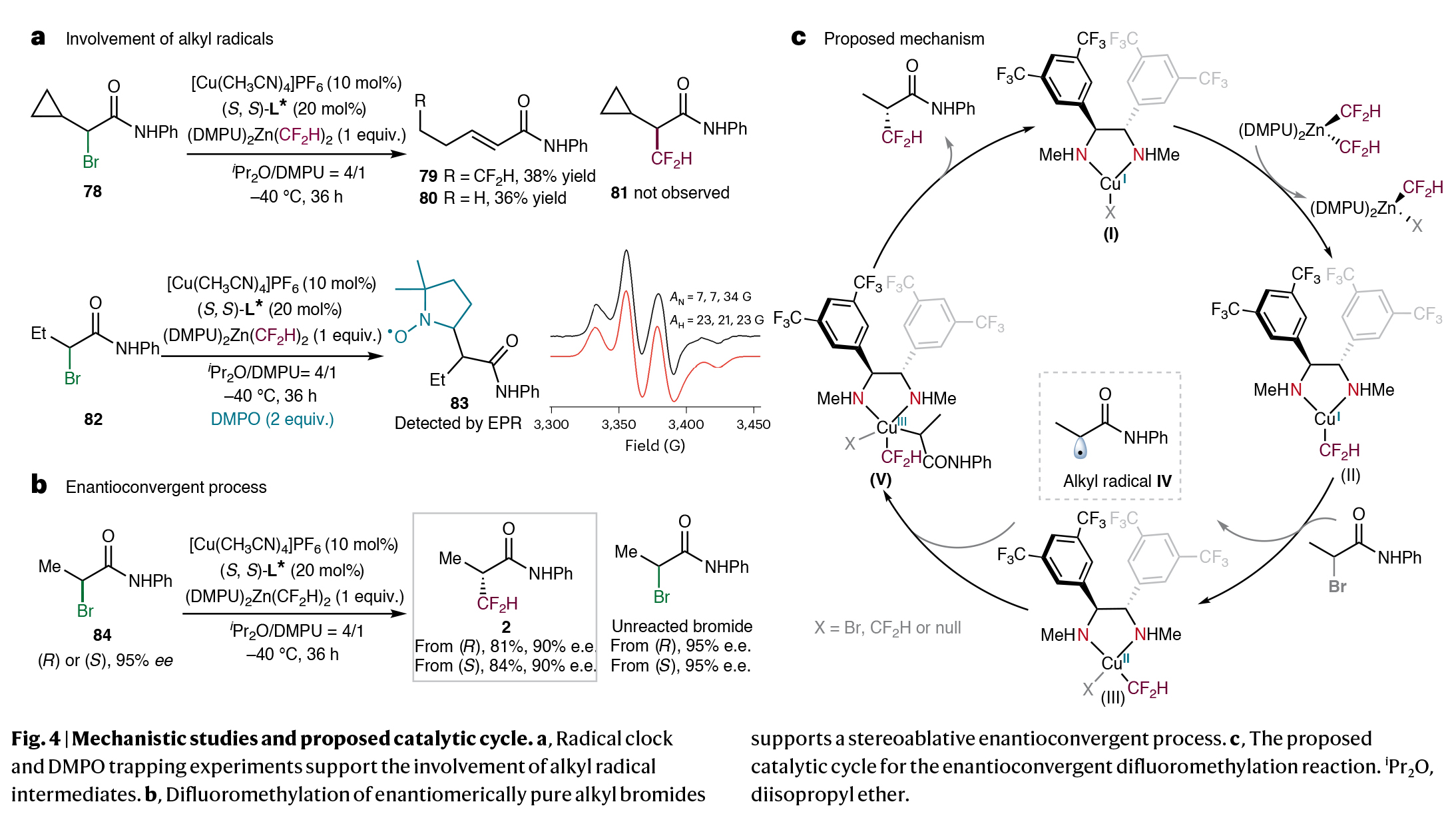
为了深入理解反应机理,作者进行了一系列控制实验(Fig. 4)。首先,当作者使用含有环丙基的底物反应时,仅得到了三元环开环的产物。随后,当作者在反应中加入自由基捕获剂DMPO(5,5-二甲基-1-吡咯啉N-氧化物)时,作者通过EPR(电子顺磁共振)观察到了自由基被DMPO捕获的产物83,由此表明该反应中涉及烷基自由基中间体(Fig. 4a)。此外,当作者无论使用R或S构型的光学纯烷基溴底物84进行二氟甲基化反应时,均以相同的产率和ee得到了相同构型的二氟甲基化产物2,由此表明此反应经历了一个对映收敛过程,而并非简单的动力学拆分或动态动力学拆分过程(Fig. 4b)。
基于上述实验结果,作者提出了此铜催化二氟甲基化反应的机理(Fig. 4c):。首先,二胺结合的铜(I)络合物I与锌-CF2H试剂发生转金属交换得到铜(I)- CF2H络合物II。随后,络合物II与烷基亲电试剂反应生成铜(II)络合物III和有机自由基IV。接下来,自由基与络合物III重新结合形成烷基-铜(III)-CF2H物种V,其经历还原消除得到二氟甲基化产物并再生铜(I)催化剂。
(图片来源:Nat. Catal.)
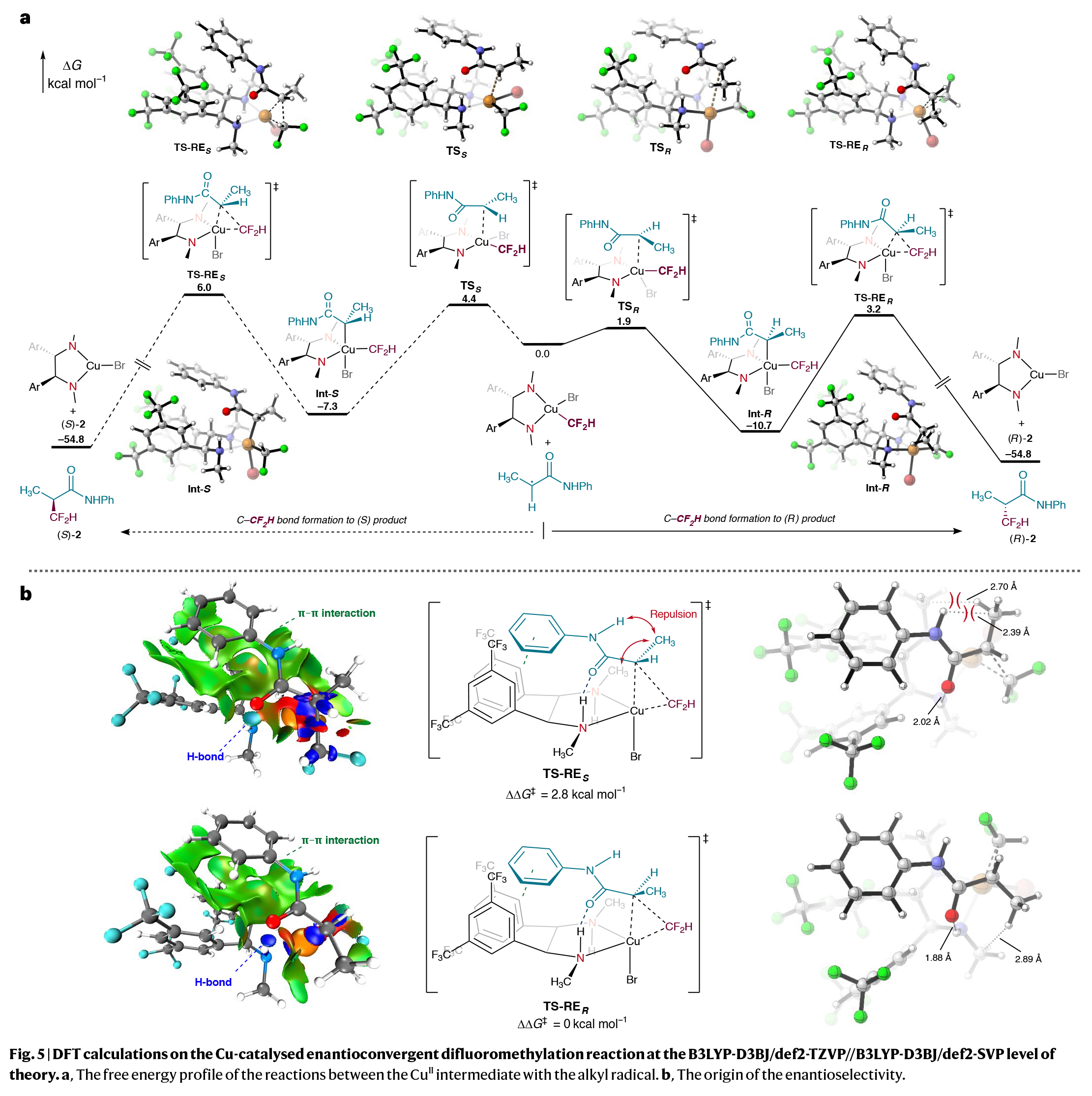
为了深入了解此二氟甲基化过程的对映选择性来源,作者进行了DFT计算(Fig. 5)。计算结果表明决定对映选择性的步骤是Cu(II)中间体到烷基自由基的基团转移。并且形成R-构型产物的过渡态(TS-RER)与形成S-构型产物的过渡态(TS-RES)相比具有更低的反应能垒。此外,在C-CF₂H键形成步骤中,自由基与配体之间的氢键和π-π相互作用决定了自由基与Cu(II)中间体接近时的构象,因此会得到特定结构的Cu(III)中间体。
(图片来源:Nat. Catal.)
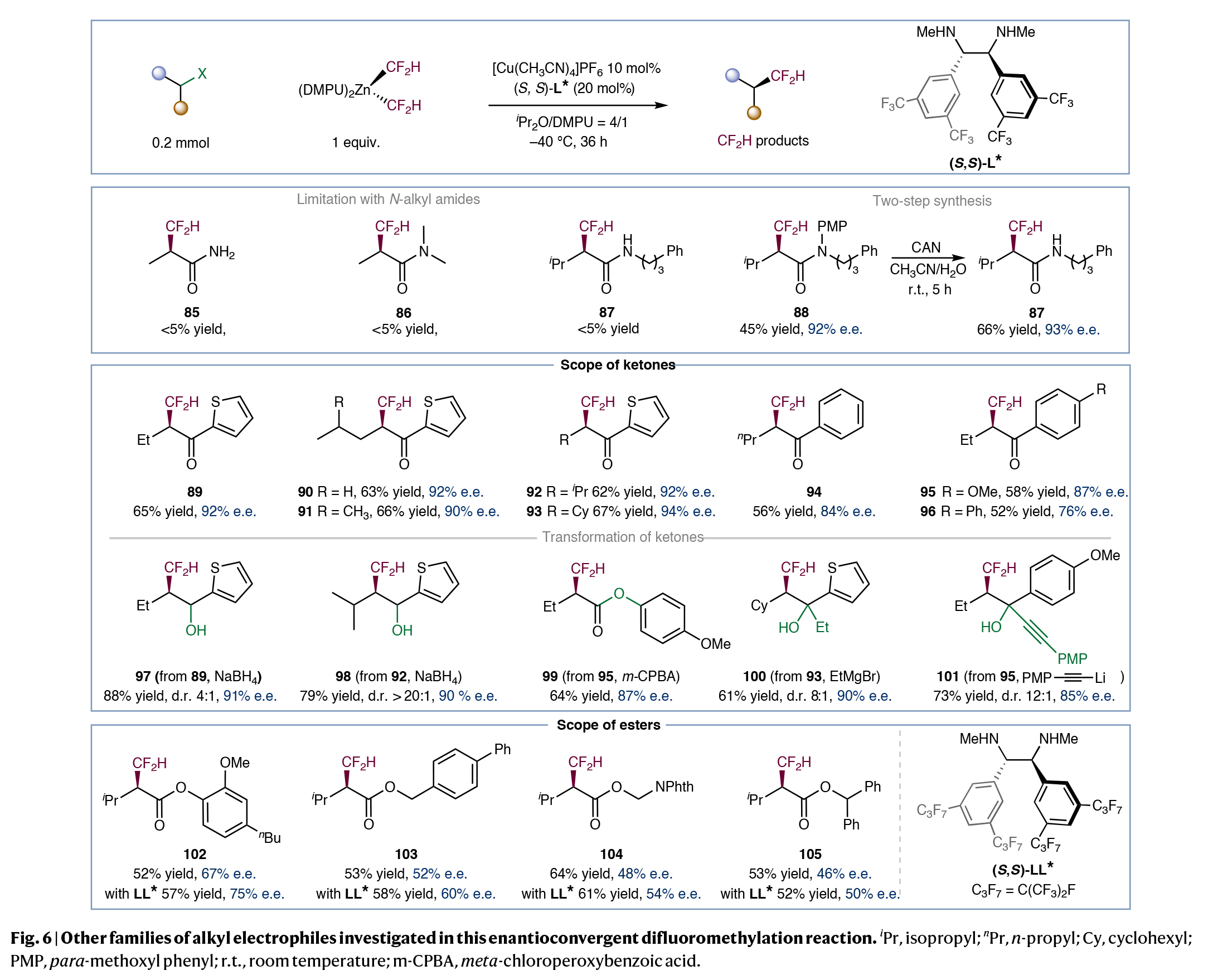
此外,该方法还可以已成功地扩展到α-溴代酮,以52-66%的产率,76-94% ee得到对映体富集的α-CF2H酮89-96(Fig. 6)。值得注意的是,富电子芳基酮(95)与电中性的芳基酮(94和96)相比,表现出更高的对映选择性,这可能是由于更强的π -π相互作用所致。鉴于酮羰基的反应性,这些产物还可以进一步构建其它含CF2H的立体中心,包括二氟甲基化的仲醇(97和98,通过NaBH4还原),酯(99,通过Baeyer-Villiger氧化)和叔醇(100和101,通过格氏或有机锂试剂)。最后,该方法还可以成功应用于α-溴代酯的二氟甲基化,尽管其可能由于较弱的非共价相互作用而具有中等的对映选择性。有趣的是,当使用含有七氟异丙基(C3F7)的手性二胺配体LL*反应时对映选择性有了一定的提高,可能是其调节了配体与底物之间的非共价相互作用所致。
(图片来源:Nat. Catal.)
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn