

正文
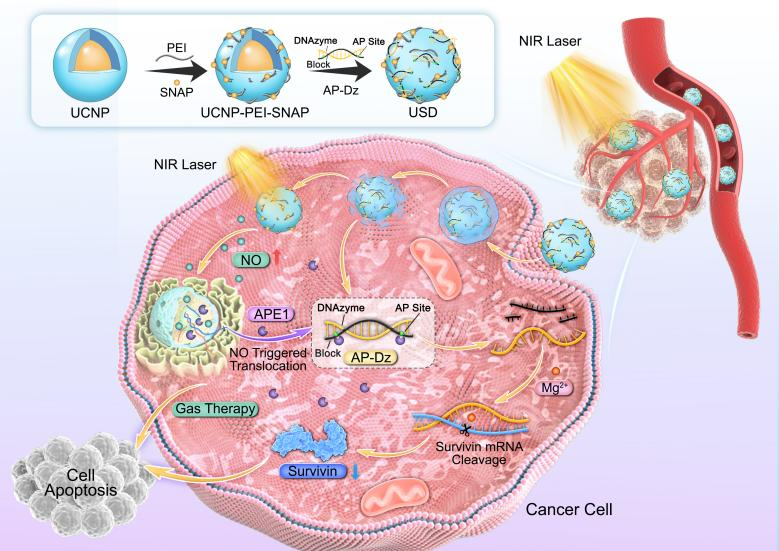
图1. USD纳米系统的合成过程及其在时空控制基因沉默和气体协同癌症治疗中的应用示意图。
本工作开发了最终一种智能纳米平台(USD),它结合了NIR光触发的NO释放和APE1诱导的治疗性DNAzymes激活,实现了时空特异性的气体-基因协同治疗(图1)。该纳米平台由三个不同的部分组成:1)UCNPs作为光传感器;2)S-亚硝基-乙酰青霉胺(SNAP)作为NO供体;3)基于DNAzymes的AP-Dz作为APE1激活的基因沉默单元。具体来说,AP-Dz是通过DNAzymes与AP链杂交建立的,其中DNAzymes可以靶向并切割靶标生存蛋白(survivin mRNA),而AP链(包含两个apurinic/apyrimidinic(AP)位点)通过与DNAzymes杂交抑制其基因治疗活性。当纳米系统在肿瘤部位积累后,NIR光照射使能量从UCNPs转移到SNAP而产生NO,导致DNA损伤实现NO气体治疗。此外,在肿瘤细胞质中过表达的APE1可以诱导AP-Dz在AP位点的裂解,恢复DNAzymes的基因治疗活性。值得注意的是,NO介导APE1从细胞核到细胞质的易位提高了DNAzymes的激活效率,从而提高基因沉默效果。总之,NIR触发的级联效应纳米系统提高了基因沉默的准确性和治疗效率,显示了基因-气体协同治疗的潜力。
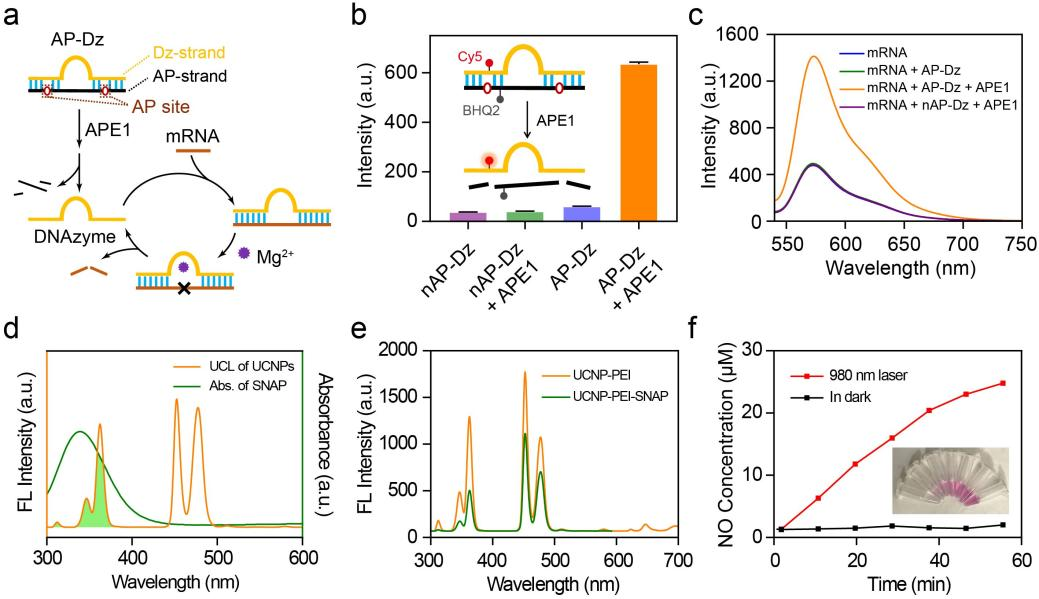
图2 溶液相实验.
作者首先对USD响应相关性能进行了验证(图2)。溶液相荧光实验证明,AP-Dz对APE1酶具有良好的响应性能,且当将靶标mRNA,AP-Dz和APE1酶共孵育时,DNAzymes表现出高效的mRNA切割能力。由于该纳米平台中UCNPs在NIR照射下的发射光谱与NO供体的吸收光谱存在明显重叠,作者探究了NIR照射下该纳米平台的NO释放能力。实验结果显示,随着NIR照射时间的延长,溶液中NO浓度不断提高,显示出该纳米平台产生NO的能力。
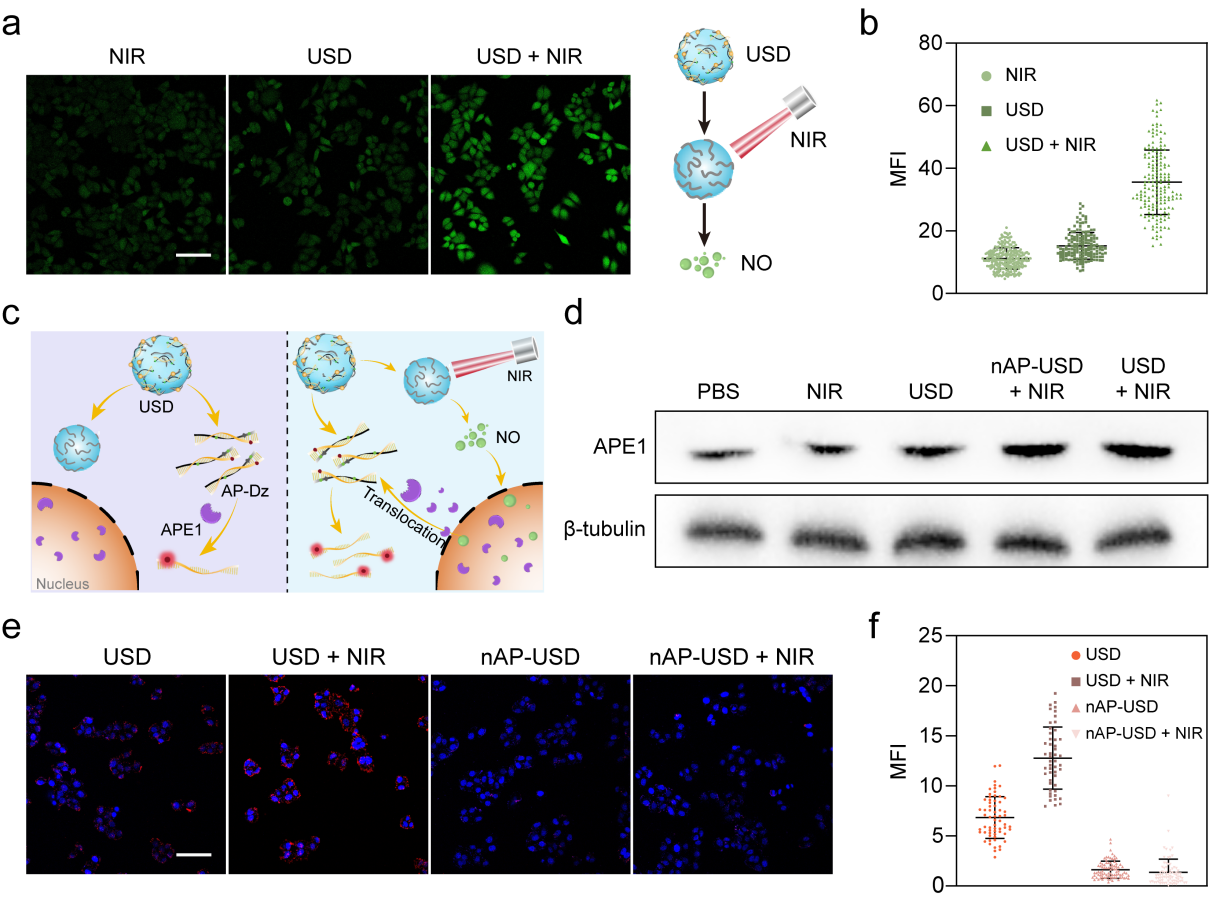
图3 细胞内NO产生与APE1响应验证.
随后作者在细胞水平考察了该纳米系统的NO产生能力(图3),共聚焦实验证明USD在NIR照射下有效产生NO,而黑暗条件下NO产生水平几乎可以忽略。通过蛋白免疫印记(WB)实验,作者验证了该纳米系统在NIR照射下引起了HeLa细胞细胞质中APE1表达水平的上调,并通过共聚焦实验验证了AP-Dz在细胞中对APE1的响应能力。共聚焦图片显示,相对于nAP-USD和nAP-USD+NIR组,USD处理组的HeLa细胞显示出增强的红色荧光信号,证明了AP-Dz响应于肿瘤细胞质中高表达的APE1酶后释放DNAzymes。特别强调的是,USD+NIR处理组的HeLa细胞显示出更强的的荧光信号,这是由于NIR激发USD产生NO,NO引起细胞质中APE1水平的升高,增强了AP-Dz的激活效果。
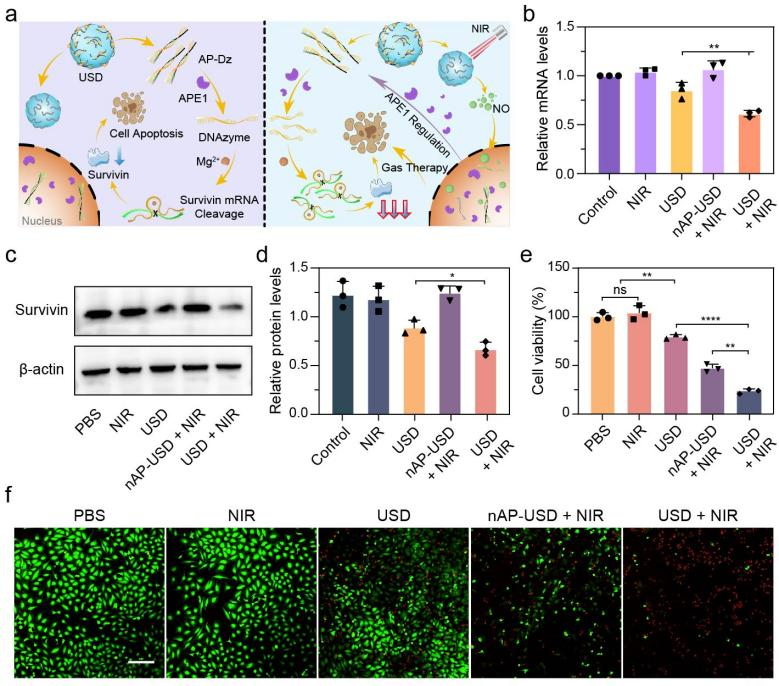
进一步对USD的基因沉默和NIR光控NO释放在细胞内治疗效果进行了探究(图4)。实时荧光定量PCR(qRT-PCR)和蛋白免疫印记(WB)实验证实,NIR激发的级联效应将有效提高靶标蛋白的沉默效果。另外,细胞毒性与活死染色实验证明,NO也将直接参与肿瘤杀伤,最终实现基因-气体协同抗肿瘤效果。
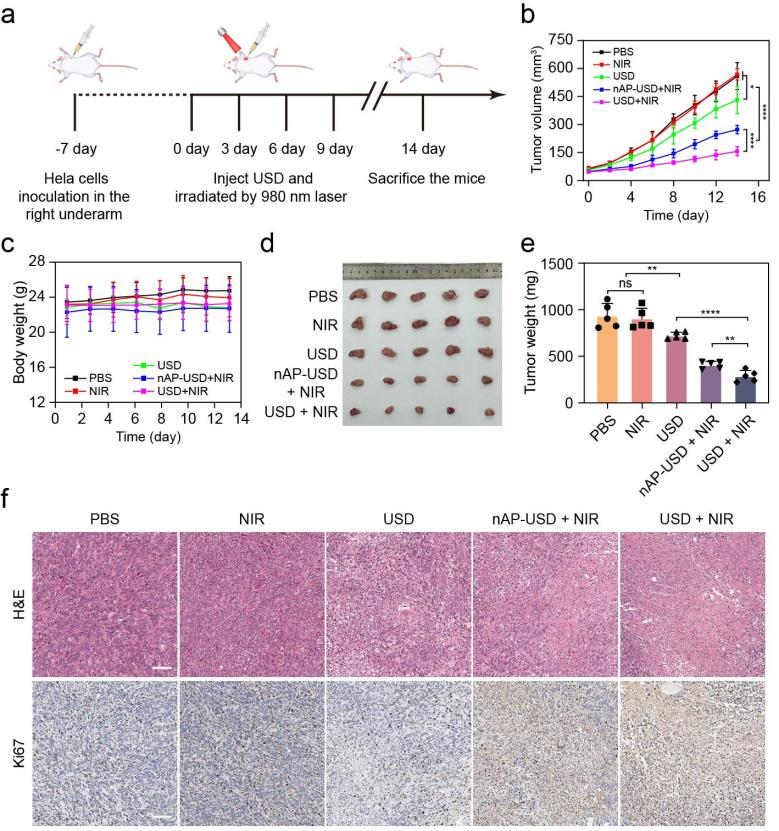
除此之外,小鼠宫颈癌肿瘤模型实验证实,该纳米系统在NIR激发下展现出良好的协同抗肿瘤能力(图5),突显了该纳米平台在精准、高效抗肿瘤中的应用潜力,也为DNAzymes在疾病精准治疗中的应用提供了参考范例。
总结
本工作开发了一种NIR触发的级联效应纳米系统,用于时空精确可控的基因沉默和气体-基因协同癌症治疗。在这个纳米系统中,UCNPs作为光转换器,在NIR光下产生NO来介导气体治疗。同时,产生的NO诱导了APE1的亚细胞重定位,从而提高了DNAzymes的激活效率。这种NIR触发的级联效应允许时空控制的基因沉默和基因-气体协同治疗,在体外和体内实现增强的抗癌效果。
论文第一作者为深圳大学博士后程亚如,通讯作者为深圳大学医学部生物医学工程学院董海峰教授。本工作得到了国家重大研究计划项目,国家自然科学基金,深圳市医学研究专项资金项目,广东省珠江团队项目和中国博士后科学基等项目的资助。
作者简介
董海峰,国家优青,深圳大学特聘教授/博导,深圳大学发展规划部副主任兼学科建设办公室主任,校学术委员会委员,深圳市纳米生物传感技术重点实验室副主任。主要从事生物分子传感及纳米药物分析研究。2010年以来,在Chem. Rev., Nat. Commun., Angew. Chem., Adv. Mater.等杂志发表SCI论文167篇,论文被引用12000余次。出版中英文专著2本,主编英文专著1本。2020-2023年科睿唯安全球高被引科学家,入选斯坦福大学“2020-2022全球前2顶尖科学家”名单及终生榜单。主要研究方向:生物传感、microRNA分析检测、纳米诊疗。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn