

(图片来源:Nature)
正文
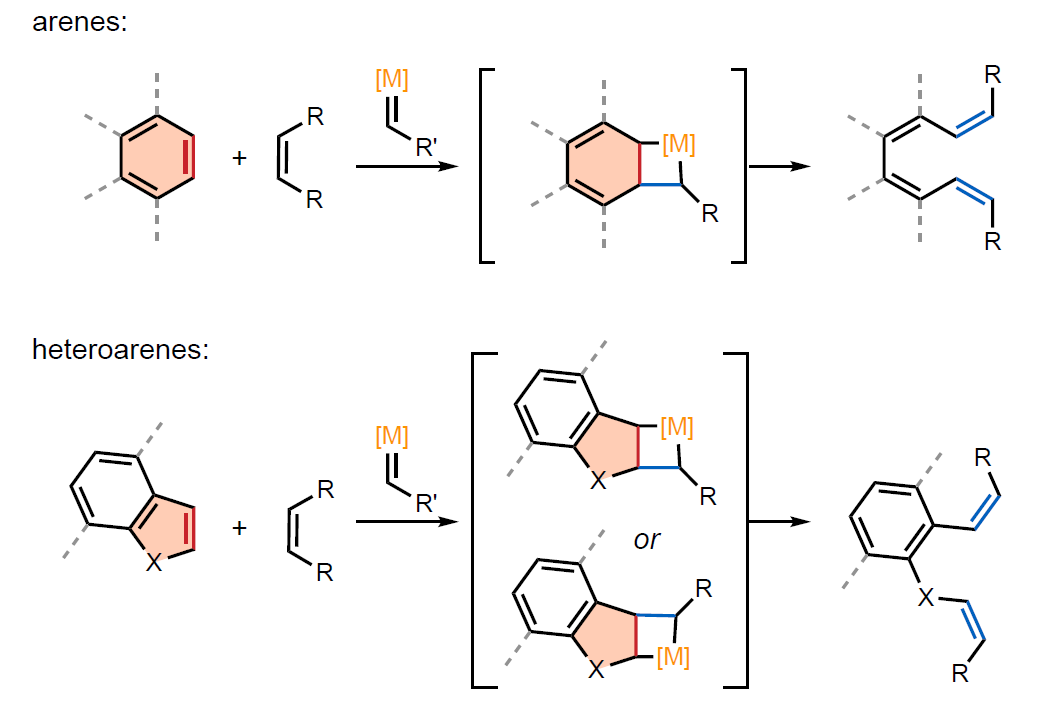
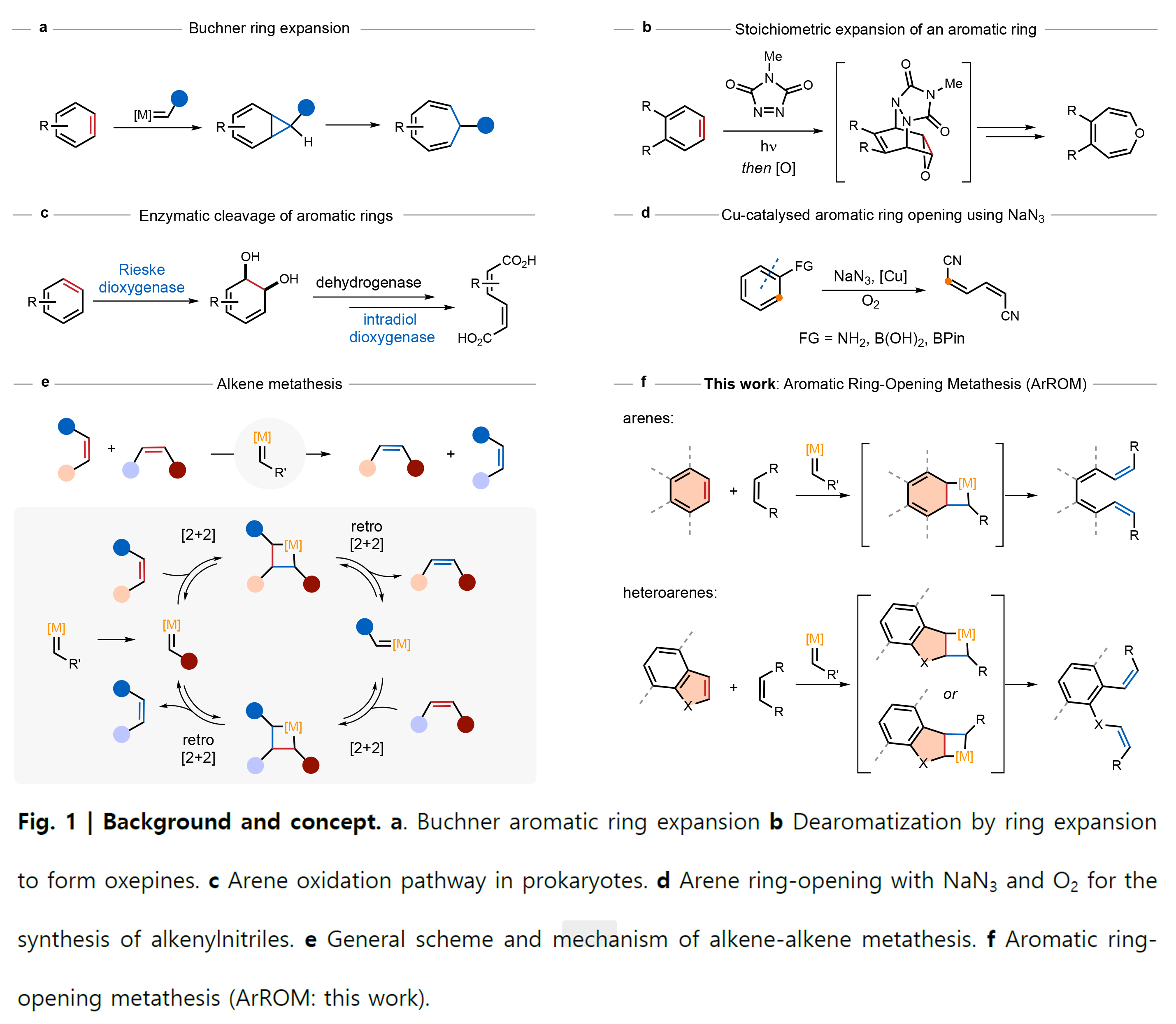
芳香族化合物由于其稳定性、特征相互作用以及确定的分子形状而广泛应用于化学和材料科学领域中。到目前为止,化学家们已经发展了多种环化反应来实现其合成。相比之下,惰性的芳香族碳-碳键断裂在很大程度上仍然是难以实现的,因为在开环时需要破坏芳香性,因此在能量上是不利的。对于非芳香结构。过渡金属亚烷基催化的烯烃复分解反应是最通用的碳-碳成键和断键反应之一。然而,尽管此领域目前取得了一定的进展,但通过复分解反应来实现芳香族化合物的开环仍有待进一步探索。最近,瑞士巴塞尔大学Christof Sparr课题组利用Schrock-Hoveyda钼催化剂实现了苯并蒽、萘、吲哚、苯并呋喃、菲等芳香环的开环复分解反应,在无需其它试剂或光激发的条件下即可实现各种芳烃的催化转化(Fig. 1)。欢迎下载化学加APP到手机桌面,合成化学产业资源聚合服务平台。
(图片来源:Nature)
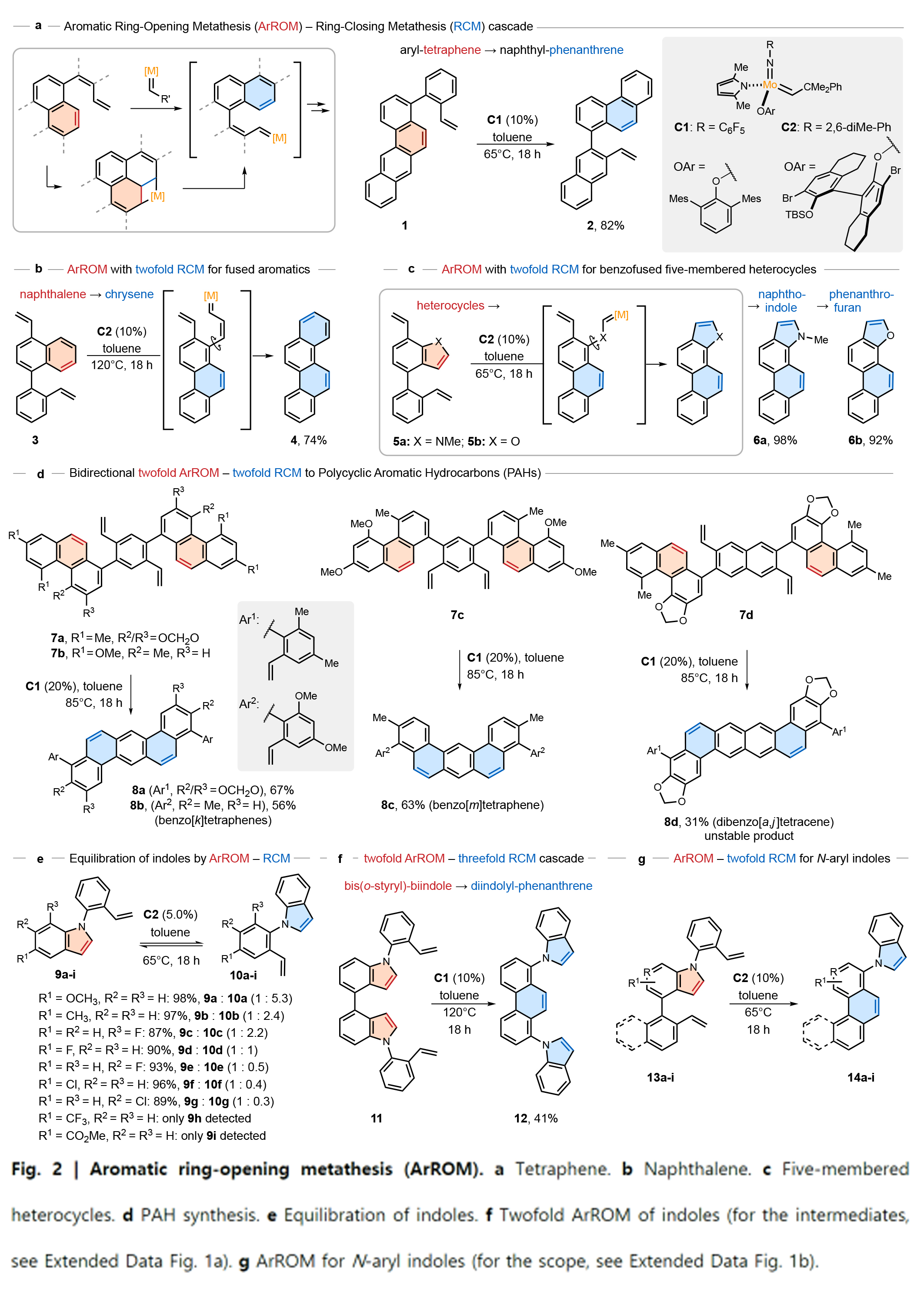
为了评估芳环开环复分解反应的可行性,作者将[2+2]环加成与芳烃形成的关环复分解步骤(RCM)相结合,以促进共同的金属环中间体开环(Fig. 2a)。令人满意的是,当使用10 mol%的催化剂在65 oC反应,可以以82%的产率得到产物2。产物2与底物1相比具有更好的热力学稳定性以及更高的整体芳香稳定性。这一结果表明,芳香环可以发生开环复分解过程。接下来,作者开始评估ArROM是否能够可以实现萘底物3的开环(Fig. 2b)。为此,作者将ArROM与双闭环复分解(RCM)串联在一起。令人高兴的是,利用此方法可以以74%的产率得到chrysene 4。接下来,作者探索了五元杂环是否可以经历ArROM(Fig. 2c)。实验结果表明,此过程可以实现相应的开环复分解过程,分别得到相应的萘并吲哚产物6a (98%)和菲并呋喃产物6b (92%)。接下来,作者又尝试将ArROM与双重RCM串联,合成了一系列多环芳烃8a-8d(31-67%)(Fig. 2d)。当使用吲哚类底物反应时,可以通过五元环的开环模式得到相应的产物10(Fig. 2e)。紧接着,作者探索了包含多芳烃开环和关环的复杂串联反应是否可行(Fig. 2f)。利用双邻苯乙烯基双吲哚11可以通过吲哚开环复分解产生的亚烷基中间体,随后参与第二吲哚部分的ArROM,以41%的产率得到菲12。
(图片来源:Nature)
基于阻转异构体的重要性,作者又探索了芳烃的阻转选择性开环复分解反应(AArROM)。首先,作者评估了菲环的开环是否可以发生,从而可以特异性的生成带有特别具有挑战性的四邻位取代基的阻转异构体(Fig. 3)。手性催化剂的选择可以控制立体中心的构象。通过一系列配体筛选,作者发现当使用Mo-二吡咯基前体时,可以实现简单易得底物15a-k的AArROM。作者很高兴地发现,当使用配体(Ra)-L1时,所获得的(Ra)-16a的对映选择性为98:2,产率为83%。接下来,作者探索了该方法的普适性。多种菲类底物均可成功经历AArROM,产生相应的产物,其阻转选择性很高,并且产率可高达98%。有趣的是,作者观察到没有联苯基邻位取代的阻转异构体(Ra)-16c的选择性有所降低。相反,对于没有任何潜在配位基团的底物15i,可以以高达 > 99:1的对映选择性得到阻转产物((Ra)-16e、(Ra)-16f、(Ra)-16j和(Ra)-16k)。
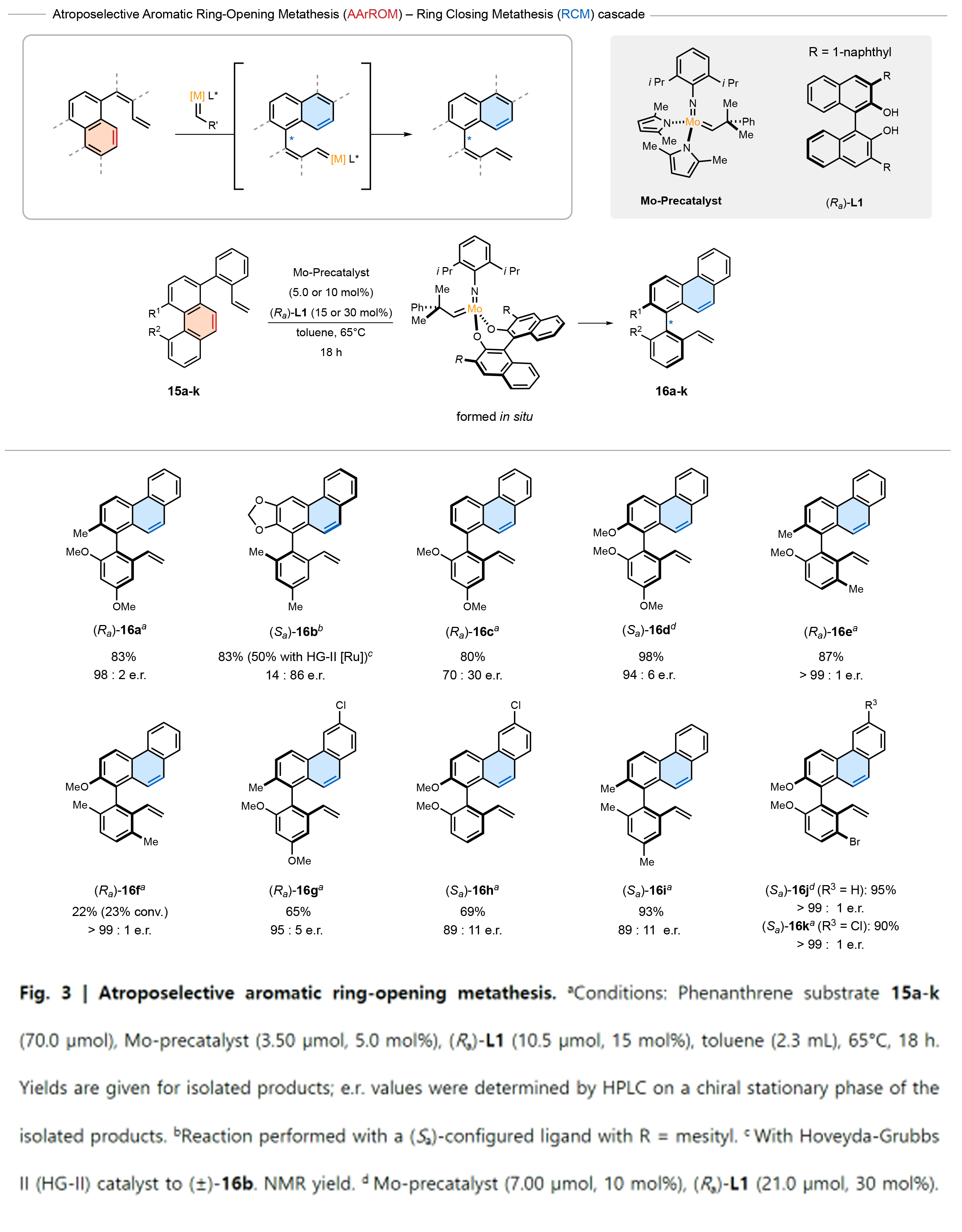
(图片来源:Nature)
受到上述结果的鼓舞,作者希望将AArROM与双重RCM相相结合,将底物17a-i转化为联菲(Fig. 4a)。令人惊讶的是,所有经过测试的双萘酚配体均展现出非凡的反应性,使得产物的选择性均非常高。此外,底物范围证实了该方法的普适性,显示出取代模式的改变并不会影响选择性,并且所有产物均以高于99:1的对映富集度获得。此外,该方法在111毫克规模,仅使用5.0 mol%催化剂前体的条件下仍然高效,并且在缺乏配位基团的底物17d上同样有效。基于上述这些发现,作者设想阻转选择性ArROM还可以拓展到杂环芳香体系(Fig. 4b)。当使用吲哚底物19a与配体(Sa)-L2反应时,所得产物20a的对映选择性为87:13,而起始原料19a的对映富集度为18:82(s =15)。相比之下,通过动态动力学拆分(DKR),立体动力学底物19c和19d产生了明显较高的对映选择性(97:3 e.r. 和96:4 e.r.)和产率(93 和91%),且通过微晶电子衍射对化合物(Sa)-20d的绝对构型进行了验证。
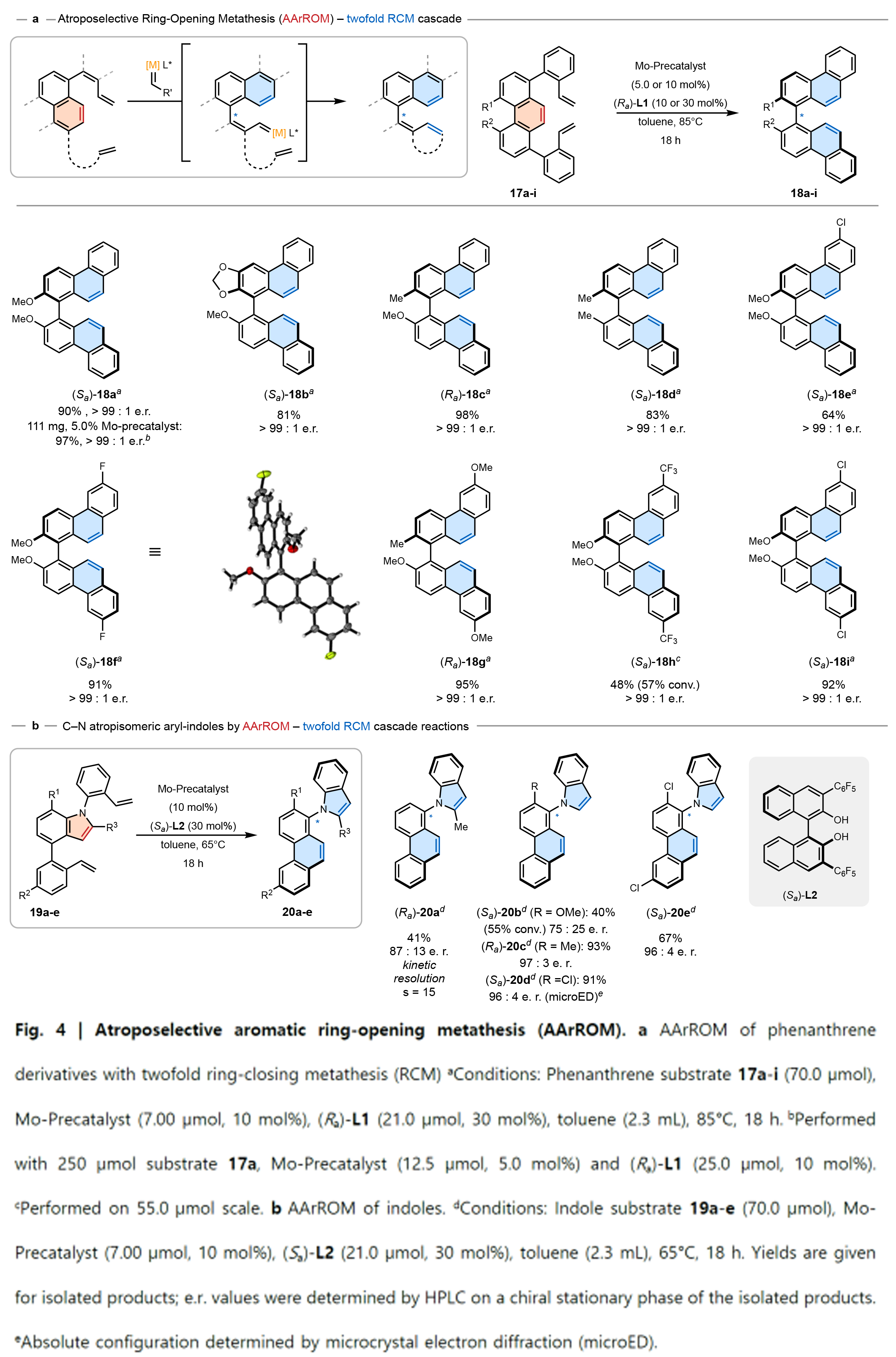
(图片来源:Nature)
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn