

正文
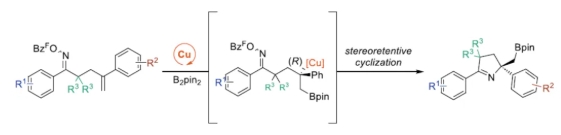
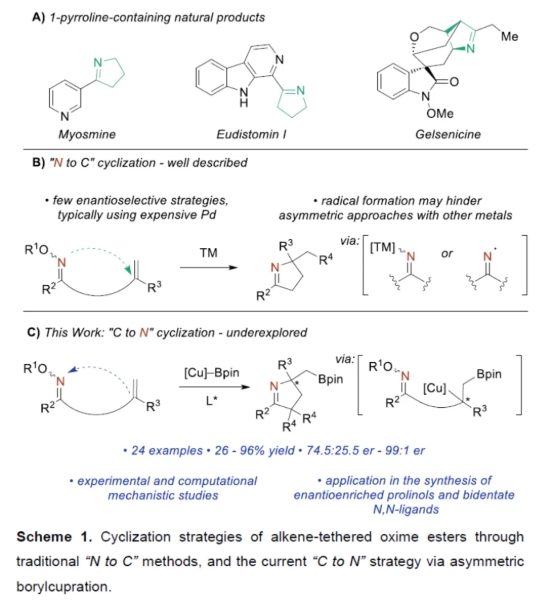
1-吡咯啉广泛存在于各类天然产物中,并可作为合成吡咯和吡咯烷衍生物的中间体(Scheme 1A)。其中,对于一些相对简单的生物碱,如Myomine和Eudistomin I,可通过烷基胺与羰基单元的缩合制备。同时,含有肟酯单元的烯烃进行环化反应,也是制备1-吡咯啉的普遍合成方法。2016年,Ferreira团队在进行Gelesenicin的全合成中利用这一策略,即通过AIBN/Bu3SnH促进iminyl-自由基在近端烯烃上的形成和环化来构建吡咯啉。此外,过渡金属也促进了这些环化反应,要么通过初始氧化加成到N-O键中,然后进行迁移插入,要么通过iminyl-自由基的形成和环化(Scheme 1B)。与其他不对称Heck型环化反应相比,由于存在竞争性的SET途径,使用钯催化含有肟酯单元的烯烃参与的不对称环化(不对称Narasaka-Heck反应)却较少有相关的研究报道。同样,使用较便宜的铜或镍催化剂促进所需的环化反应,通常也是通过自由基途径进行的。Lautens团队假设,如果串联的初始步骤能够防止N-O键的氧化加成,即可避免与此类底物进行环化的限制。近日,加拿大多伦多大学Mark Lautens与Bijan Mirabi团队报道了一种铜催化γ,δ-不饱和肟酯的对映选择性硼铜化/环化反应,合成了一系列硼基取代的1-吡咯啉衍生物(Scheme 1C)。值得注意的是,2020年,吴小峰教授课题组(Org. Chem. Front. 2020, 7, 3382.)虽然报道了关于含有肟酯单元的烯烃进行硼化环化反应,但对于环化步骤的机理以及相应的不对称转化,尚未报道。 欢迎下载化学加APP到手机桌面,合成化学产业资源聚合服务平台。
(图片来源:Angew. Chem. Int. Ed.)
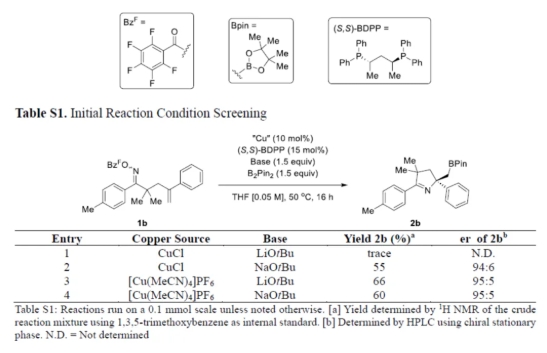
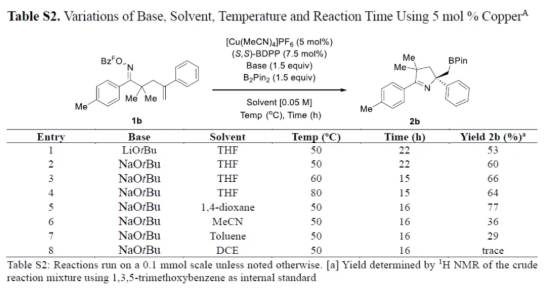
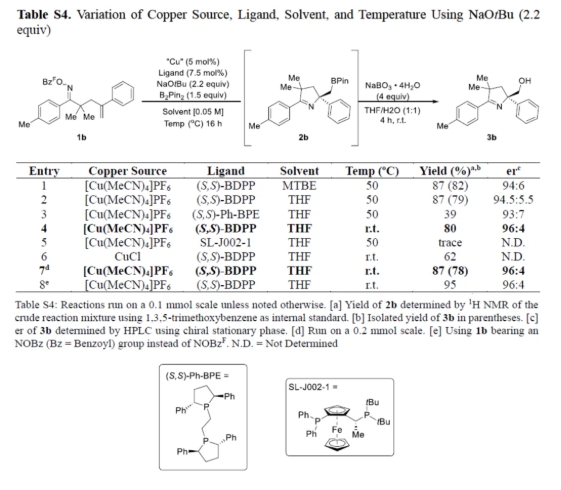
首先,作者以含有肟酯单元的烯烃衍生物1b作为模型底物,进行了相关反应条件的筛选(Tables S1-S4)。当以[Cu(MeCN)4]PF6(5 mol %)作为催化剂,S,S-BDPP(7.5 mol %)作为配体,NaOtBu(2.2 equiv)作为碱,B2pin2(1.5 equiv)作为硼源,在THF溶剂中室温反应,可以87%的收率得到产物3b,er为96:4。
(图片来源:Angew. Chem. Int. Ed.)
(图片来源:Angew. Chem. Int. Ed.)

(图片来源:Angew. Chem. Int. Ed.)
(图片来源:Angew. Chem. Int. Ed.)
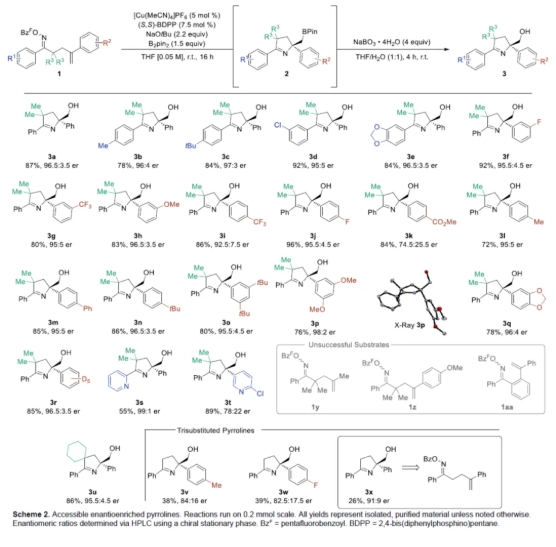
在获得上述最佳反应条件后,作者对底物范围进行了扩展(Scheme 2)。其中,由于快速柱色谱纯化过程中化合物2的不稳定性,导致其在氧化后分离为相应的醇3。当底物1中的R1为-Me、-tBu、-Cl与-OCH2O-时,均可顺利反应,获得相应的产物3b-3e,收率为78-92%,er为95:5-97:3。当底物1中的R2为-F、-CF3、-OMe、-CO2Me、-Me、-Ph、-tBu、-OCH2O-与-D5时,也与体系兼容,获得相应的产物3f-3r,收率为72-96%,er为74.5:25.5-98:2。同时,当底物1中的芳基替换为吡啶基时,反应也能够顺利进行,获得相应的产物3s(收率为55%,er为99:1)和3t(收率为89%,er为78:22)。当使用环己基取代偕二甲基时,可以86%的收率得到螺环吡咯啉产物3u,er为95.5:4.5。然而,几种底物(如1y、1z和1aa)未能有效的进行反应。此外,通过该策略,还可合成三取代的吡咯啉产物3u-3w,收率为38-86%,er为82.5:17.5-95.5:4.5。
(图片来源:Angew. Chem. Int. Ed.)
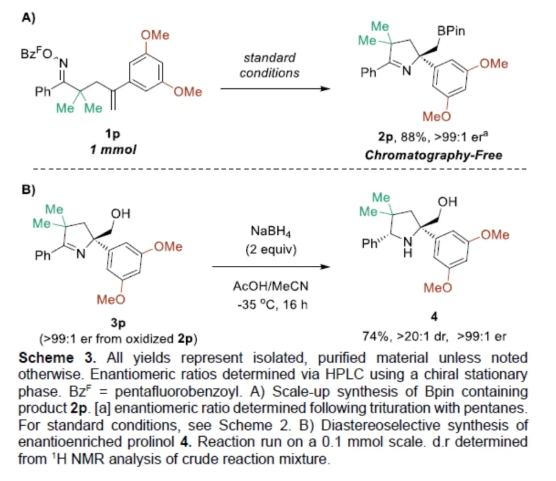
紧接着,作者对反应的实用性进行了研究(Scheme 3)。首先,1p在1 mmol规模实验,同样能够以88%收率得到产物2p,er>99:1。其次,3p在MeCN/AcOH/NaBH4条件下进行亚胺的还原,可以74%收率得到吡咯化合物4,er>99:1,dr>20:1。
(图片来源:Angew. Chem. Int. Ed.)
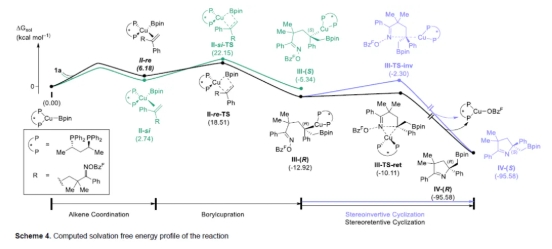
此外,作者还对反应机理进行了相关的理论计算研究(Scheme 4)。最初,在烯烃的配位反应中,涉及Cu-Bpin配合物迁移插入π-键中,然后进行亲电捕获。进一步的计算结果表明,底物1a的re面与Cu-Bpin配合物I的结合所需的能量较低(II-re)。其次,在硼铜化反应中,通过非对映过渡态(II-re-TS)生成(R)-苄基铜III-(R)在能量上更有利。因此,在反应条件下优选的迁移插入可选择性的生成III-(R)。最后,立体保留环化反应中,III-TS-ret通过释放Cu-OBzF配合物,从而生成硼化产物IV-(R)。
(图片来源:Angew. Chem. Int. Ed.)
为了合理解释环化的机理偏好,作者对竞争性环化过渡态III-TS-ret和III-TS-inv中存在的非共价相互作用(NCIs)进行了分析(Scheme 5)。定性结果揭示了III-TS-ret中额外的稳定相互作用,这可能解释了发生立体保留环化的显著偏好。
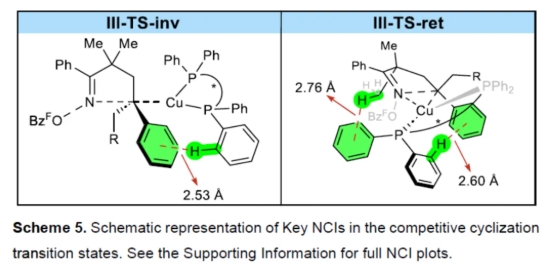
(图片来源:Angew. Chem. Int. Ed.)
最后,作者通过控制实验以及氘代实验,从而进一步证明了机理的合理性(Scheme 6)。自由基抑制实验结果表明,反应不涉及自由基的机理。氘代实验结果表明,最初的不对称硼铜化过程,能够非对映选择性形成(R)-苄基铜配合物III-(R)。同时,III-(R)经立体保留的方式进行环化,从而获得IV-(R)。
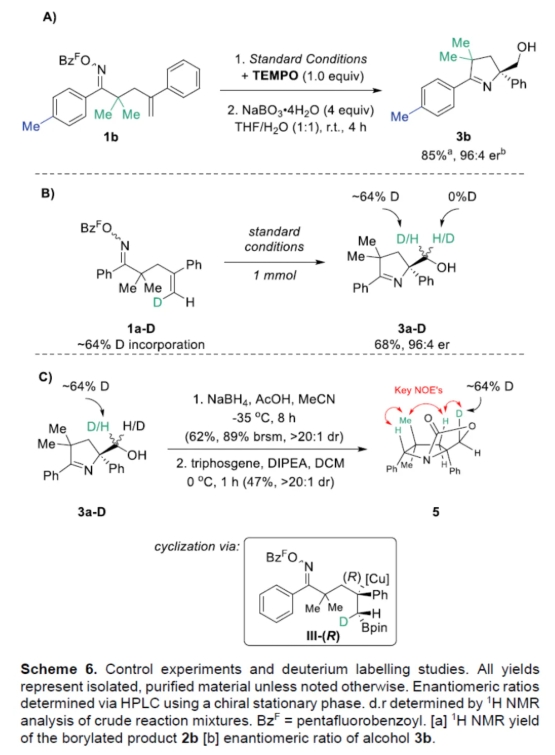
(图片来源:Angew. Chem. Int. Ed.)
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn