

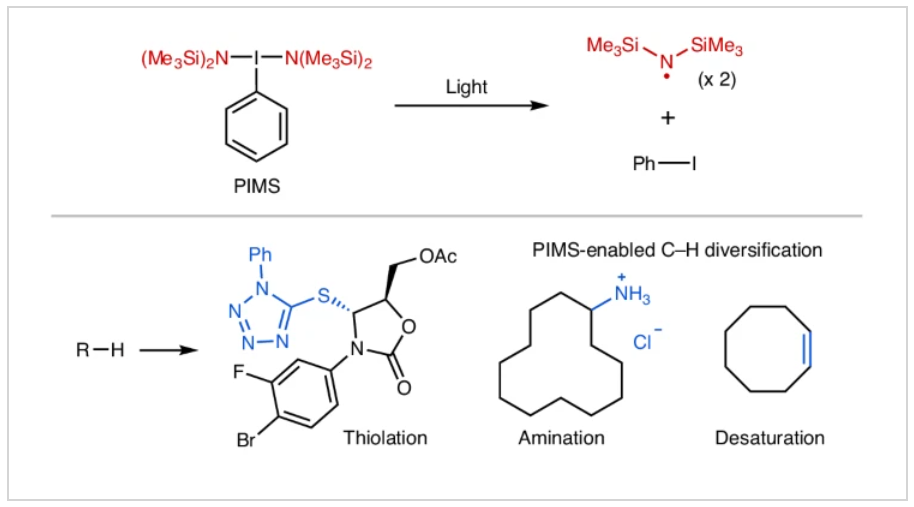
正文
(图片来源:Nat. Chem.)
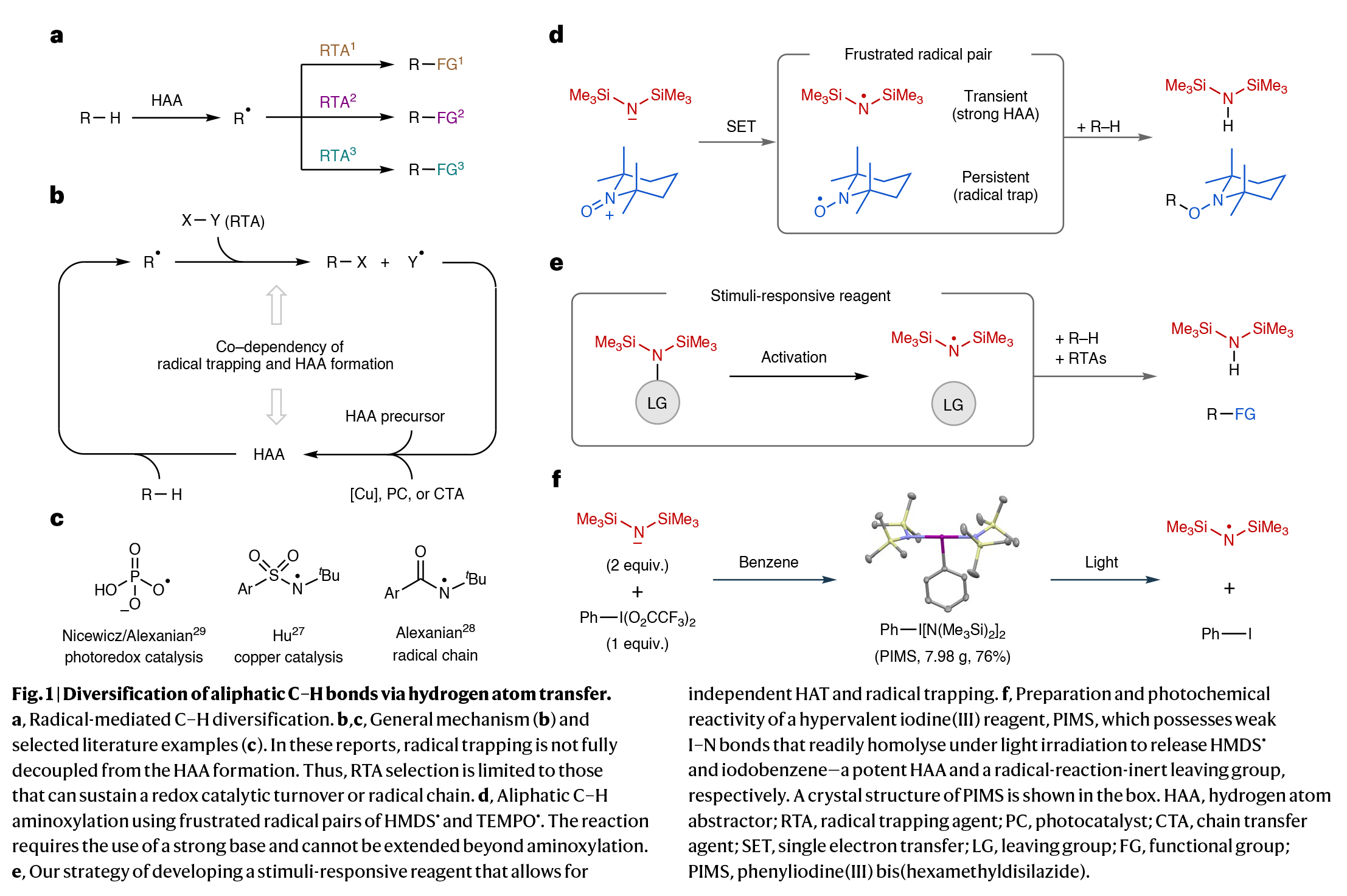
PIMS试剂利用市售的双(三甲基硅基)氨基锂和[双(三氟乙酰氧基)碘]苯合成,其可以在多克规模上制备。通过单晶X-射线单晶衍射分析,PIMS显示出碘中心呈T形几何结构,N–I–N键角为179.08(5)°,N–I–C键角范围为90.08(6)°至90.81(6)°。I–N键距离分别为2.2069(13) Å和2.1953(13) Å,均长于原子共价半径之和(2.10 Å)。DFT计算预测I–N键的平均键能为20 kcal mol−1,表明这些键易于发生均裂。差示扫描量热分析显示,PIMS在82.6 °C熔化并随后降解为碘苯。PIMS的紫外-可见光谱在紫外区域显示出吸收特征,其尾部延伸至可见光范围。
首先,作者以1作为硫化试剂,环十二烷2作为模板底物对C-H活化反应进行探索(Table 1)。经过一系列条件筛选, 作者发现当使用1(1.0 equiv),2(10.0 equiv),PIMS(1.0 equiv),在三氟甲苯中440 nm光照下室温反应18小时,能够以80%的产率得到相应的C-H硫化产物。控制实验表明在没有PIMS存在以及光照时反应效率大大降低。在得到了最优反应条件后,作者对此转化的底物范围进行了考察。一系列不同取代的单环烷烃、直链烷烃、双环烷烃、硅烷、芳香族化合物以及杂环化合物等均可顺利实现转化,以15-82%的产率得到相应的硫化产物3-30。一系列不同的官能团如卤素、邻苯二甲酰亚胺、硝基、腈基和酯基等均可兼容。
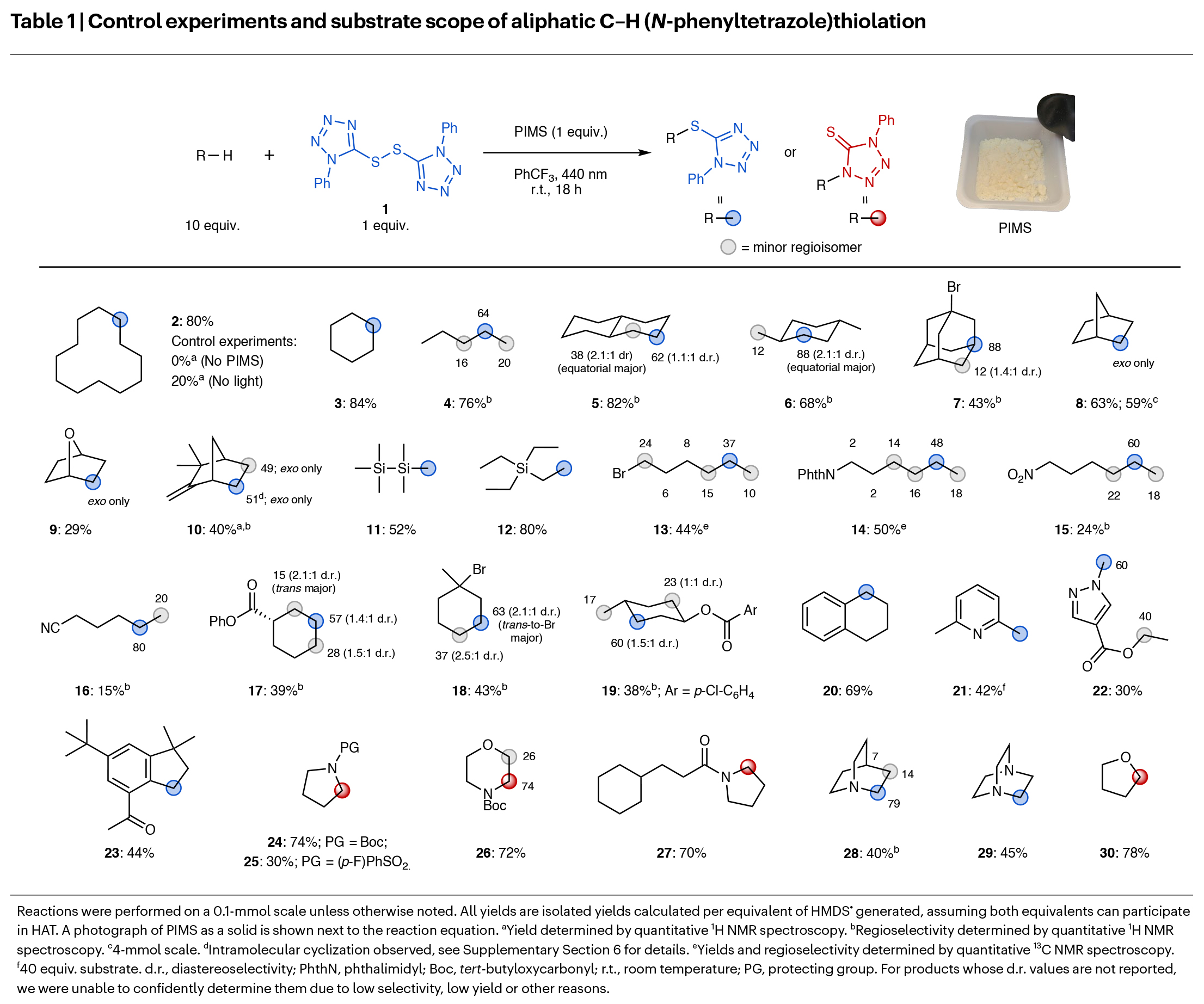
(图片来源:Nat. Chem.)
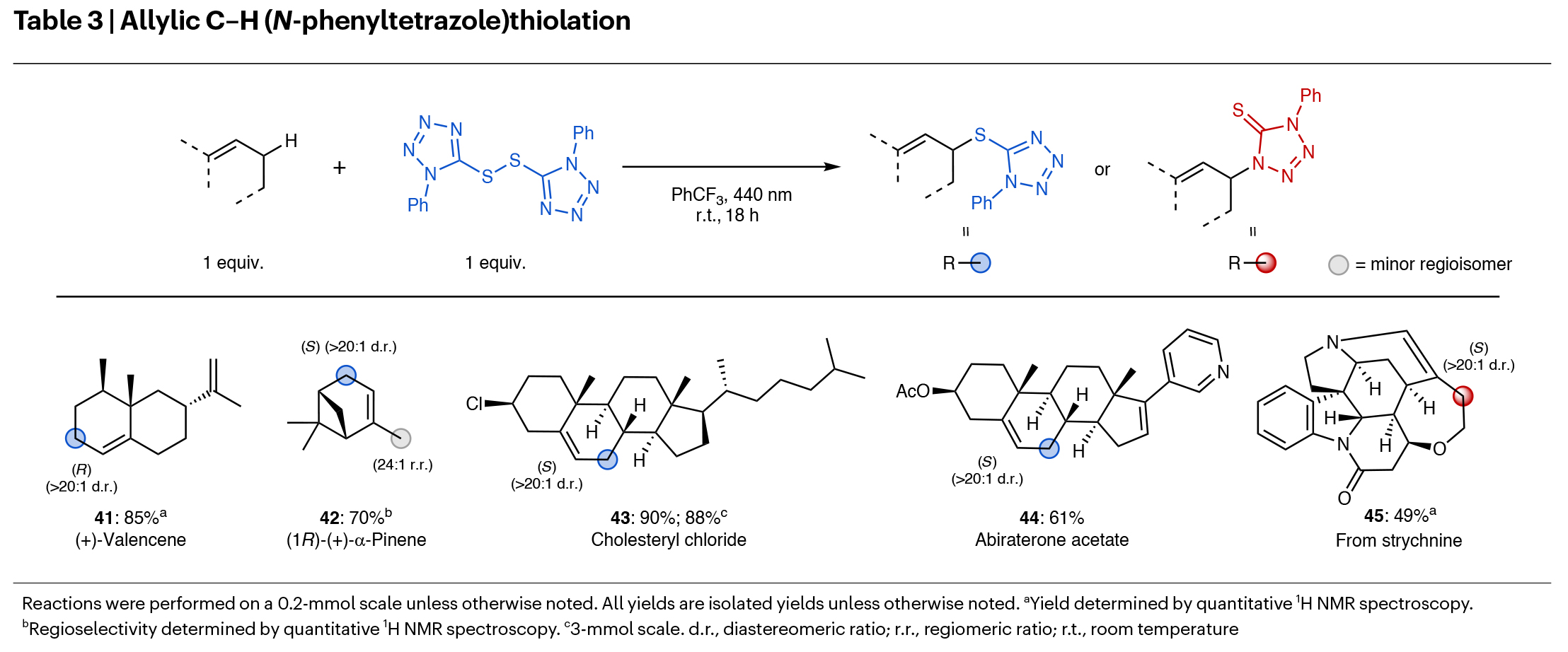
随后,作者对实验方案进行了改进,以实现更复杂底物的官能团化(Table 2)。一系列天然产物和药物相关分子,如脱氢松香酸甲酯(31)、八氢吡咯并[3,4-c]吡咯(32)、脯氨酸衍生的酰胺(33)、氮杂环丁烷(34)、噁唑烷酮(35)、双环吗啉(36)和(-)-ambroxide(37),均在苄位或α-杂原子取代位点上展现出高区域选择性并得到相应的产物31-37(26-72%)。此外,该方法适用于糖类衍生物的官能团化,包括保护的β-d-吡喃果糖(38)和达格列净四乙酸酯(39)。此外,作者还发现当使用仅含有非未活化C-H键的环己烷(3)和(+)-长叶烯(40)反应时,虽然产率中等,但区域选择性和立体选择性较高。此外,该策略还可以实现烯丙基C-H键硫化,反应在无需PIMS存在的条件下即可进行,且适用于多种复杂天然产物和药物分子(Table 3)。遗憾的是,此方法对非环烯烃和茚不适用。
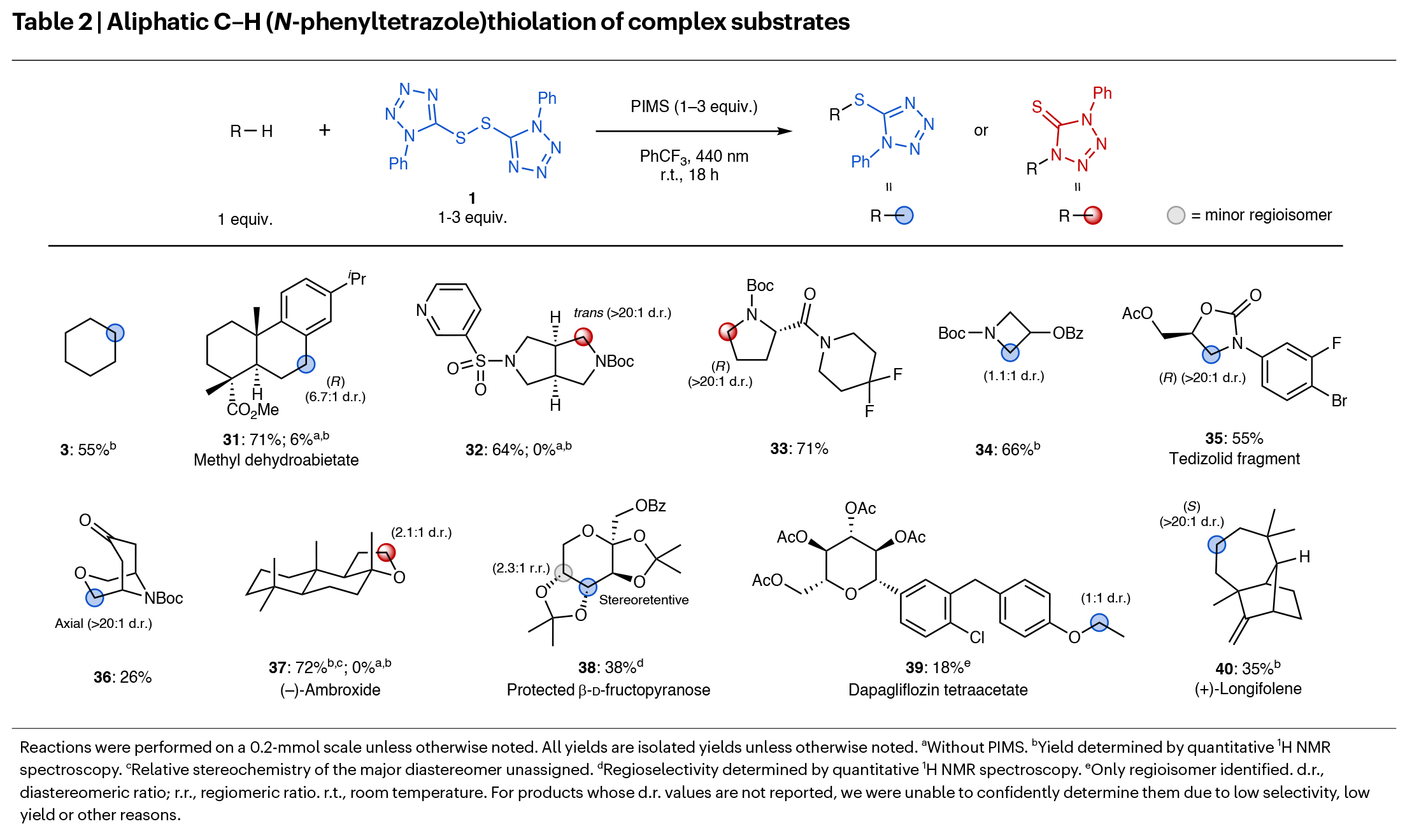
(图片来源:Nat. Chem.)
(图片来源:Nat. Chem.)
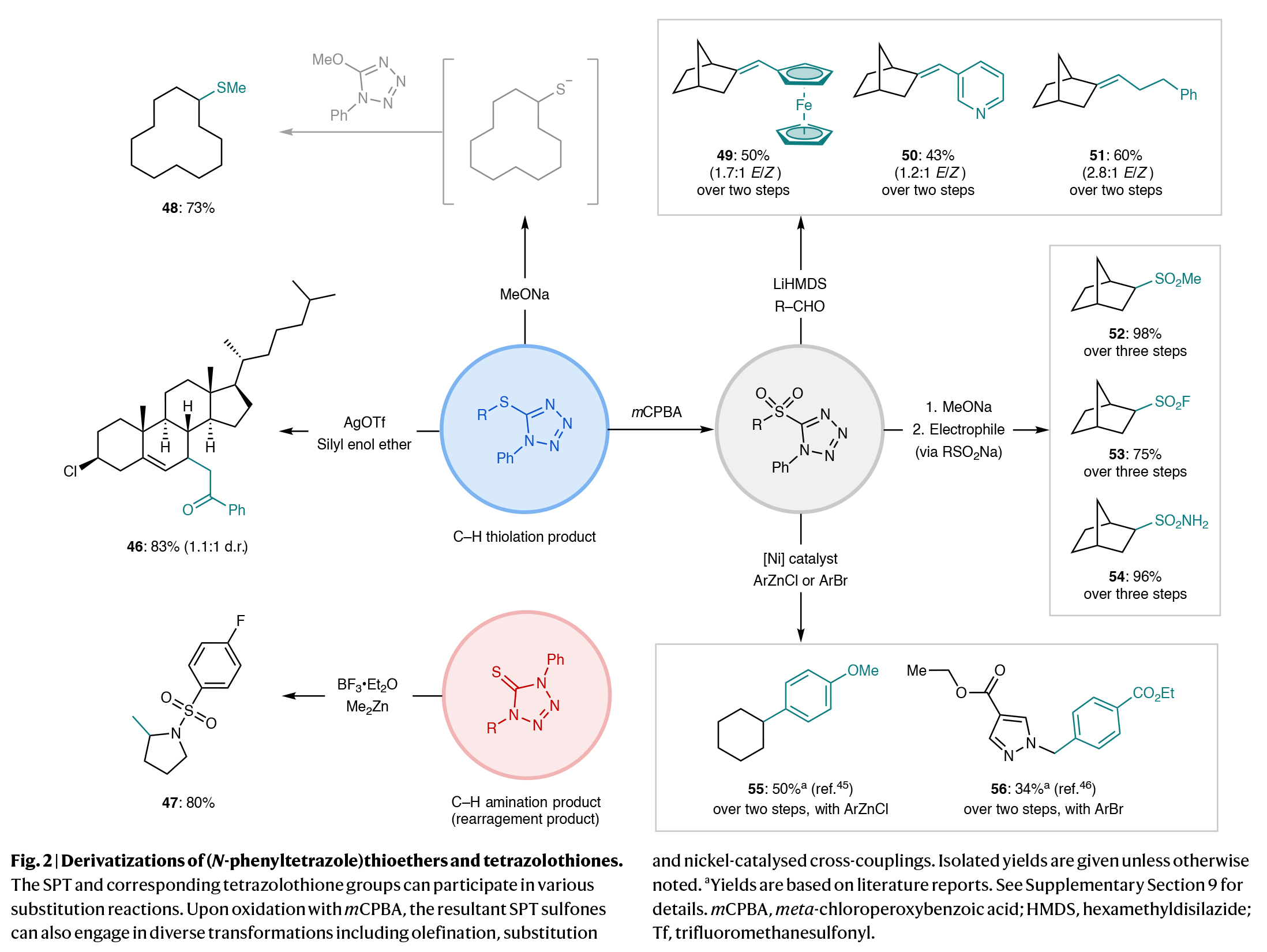
为了证明硫化产物的实用性,作者将产物的SPT部分通过亲核取代、氧化、脱保护等反应进行了多样化衍生。当SPT中的硫醚氧化为砜后,可通过Julia-Kocienski烯基化、取代反应和镍催化交叉偶联等反应实现转化(Fig. 2)。
(图片来源:Nat. Chem.)
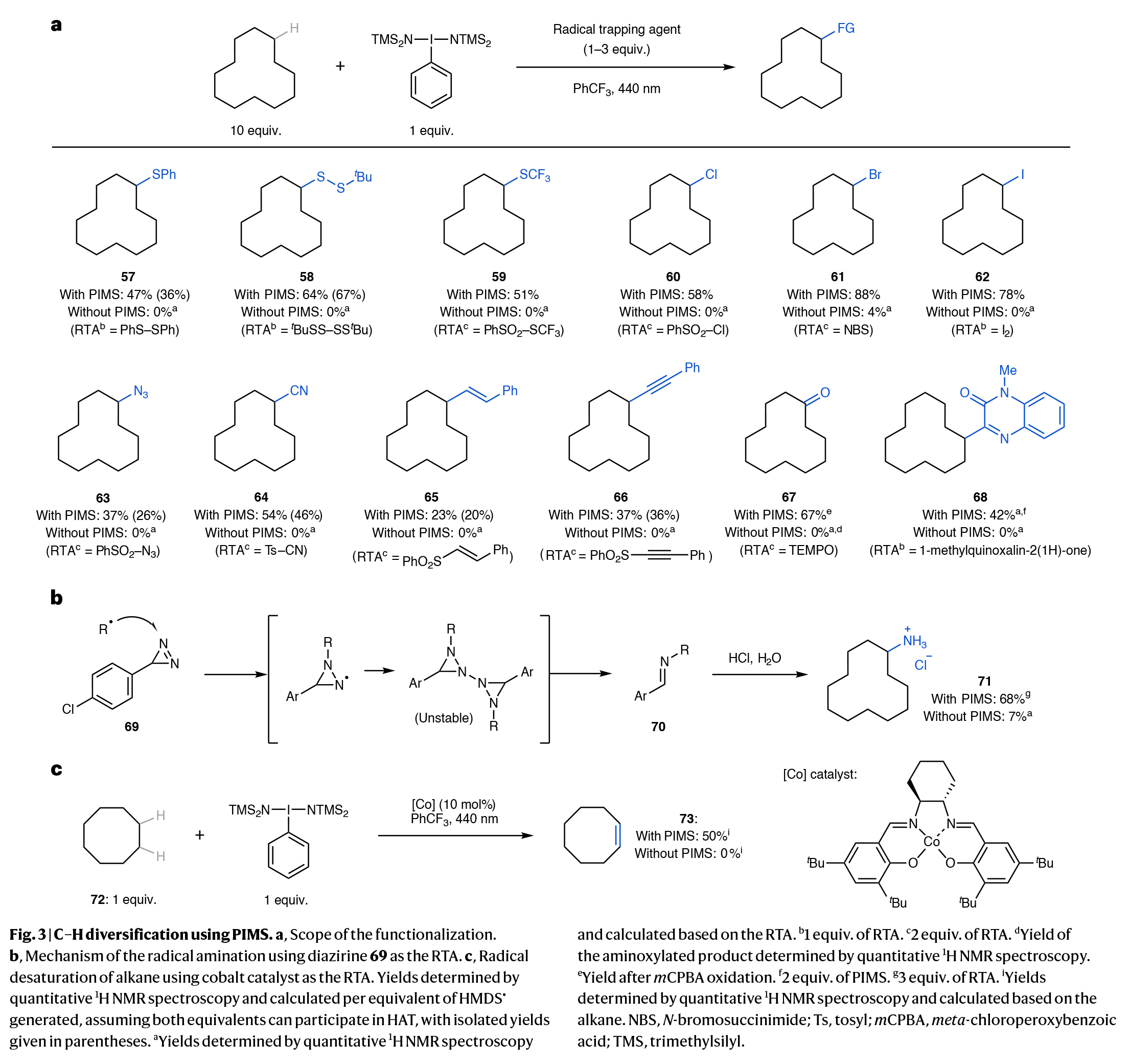
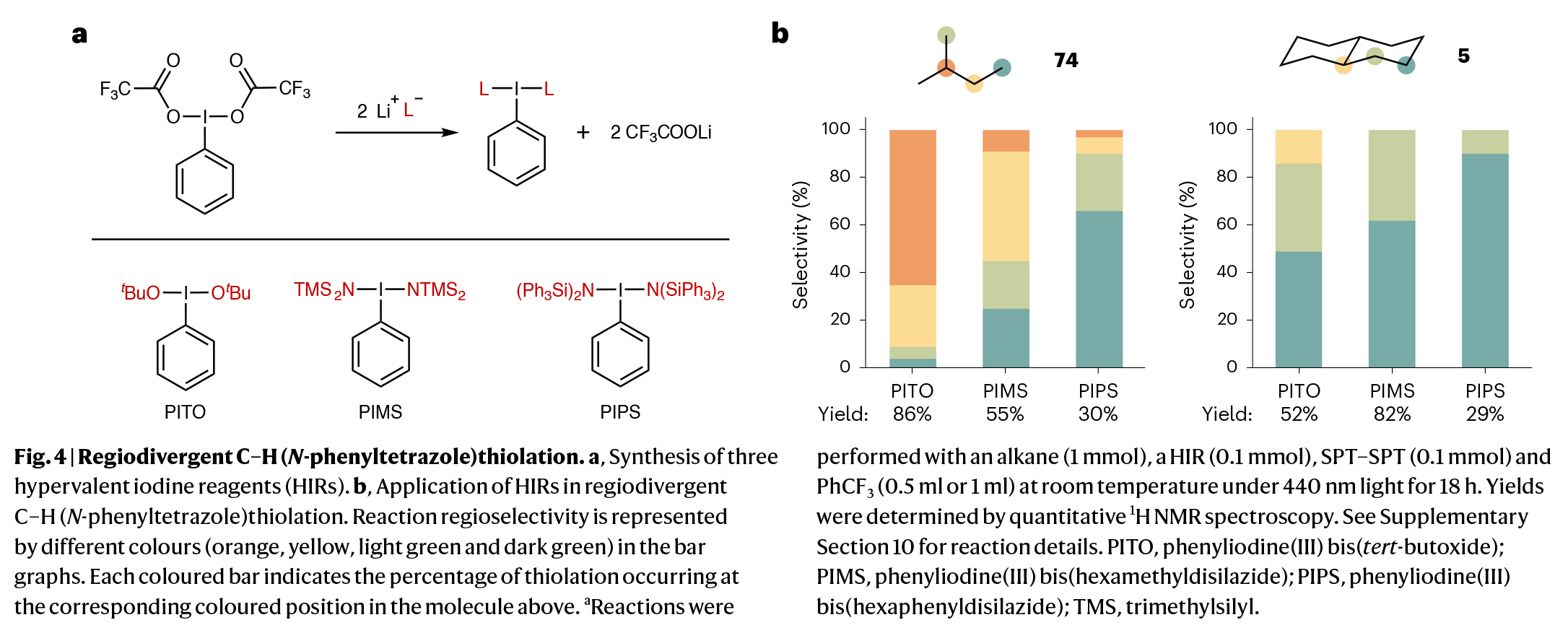
值得注意的是,通过对自由基捕获剂(RTA)的改变,作者利用PIMS还可实现多种不同类型的C-H键官能团化反应(如C-H卤化、叠氮化、氰化、烯基化、炔基化)等。重要的是,该方法与以往报道的方法有所不同,其氢原子攫取剂的生成与自由基捕获步骤完全分离。因此,原则上RTA的选择范围更广,因为无需考虑其是否能够周转光催化剂、金属催化剂或维持自由基链,这与之前的相关报道不同。此外,作者还能利用钴催化反应策略来实现环烷烃的脱氢来合成烯烃(Fig. 3)。此外,作者通过研究发现,当使用不同结构的高价碘试剂,如PITO、PIMS和PIPS时,可以实现区域发散的C-H官能团化过程(Fig. 4)。
(图片来源:Nat. Chem.)
(图片来源:Nat. Chem.)
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn